По мнению N. Gupta, процесс транссинаптической дегенерации объединяет глаукому с другими нейродегенеративными заболеваниями, такими как болезнь Альцгеймера. Ключевым моментом в развитии этих заболеваний является акcонопатия, которая характеризуется нарушением аксонального транспорта и дистальной дегенерацией. Сравнительные исследования патологии аксонов при различных болезнях привели к пересмотру классической точки зрения гибели нейронов, в которых дегенерация дендритов и аксонов происходит после повреждения тела клетки.
Дистальные отростки нейронов и их синапсы являются наиболее уязвимым местом при дегенеративном процессе. Их повреждение в свою очередь приводит к гибели нейрона и, как следствие, к дезинтеграции функций. Так, например, при болезни Альцгеймера нарушение аксонального транспорта предшествует повышению синтеза -амилоида, что в конечном итоге приводит к потере синаптических связей между нейронами. Все это в результате приводит к массивной гибели нейронов головного мозга, что является пато-гномоничным признаком болезни.
В своем исследовании на мышах Calkins и Crish показали, что так же, как и при других нейродегенеративных заболеваниях, дистальные акcоны первыми повреждаются при глаукоме. Нарушение аксонального транспорта прогрессирует в проксимальном направлении и распространяется от НКТ к ЗН, а затем и к сетчатке. Кроме того, было выявлено, что аксонопатия прогрессирует с возрастом и не всегда связана с повышенным ВГД: офтальмогипертензия вызывала нарушение аксонального транспорта у взрослых мышей и не влияла на него у молодых.
Таким образом, было сделано предположение, что дегенеративный процесс начинается в головном мозге и лишь потом распространяется на ЗН и сетчатку.
Еще одним доказательством аксонопатии служит обнаружение в сетчатке при глаукоме патологического тау-белка. Тау-белок принадлежит к группе белков, ассоциированных с микротрубочками и обеспечивающих аксональный транспорт в здоровых нервных клетках. Гиперфосфорилирование тау-белка приводит к разрушению микротрубочек, нарушению аксонального транспорта и оказывает токсическое воздействие на нейроны. Патологический тау-белок в виде нейрофибриллярных клубков при болезни Альцгеймера является патогномоничным признаком этого заболевания.
Нормальный тау-белок расположен во внутреннем ядерном и внутреннем плексиформном слоях сетчатки человека, а также в преламинарном и постламинарном отделе ЗН. N. Gupta и Y. Yucel обнаружили патологический тау-белок (АТ8) во всех препаратах глаз, энуклеированных по причине неконтролируемого ВГД. Используя иммуноцитохимический анализ, они определили локализацию патологического тау-белка.
Во всех случаях он располагался на наружной границе внутреннего ядерного слоя и во внутреннем плексиформном слое, в ЗН отсутствовал (рис. 12-13). Учеными был сделан вывод о том, что патологический тау-белок принимает участие в нарушении стабильности микротрубочек, повреждении аксонального транспорта и, как следствие, способствует развитию нейродегенеративного процесса при глаукоме.
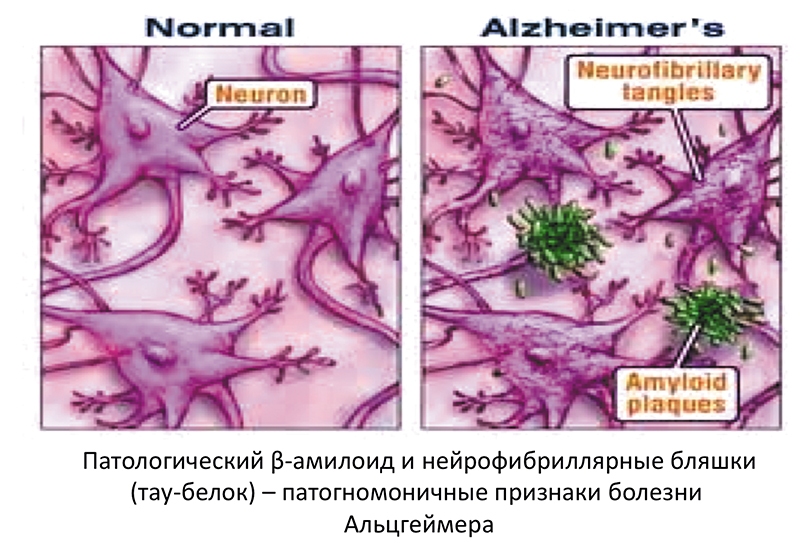
Рис.12
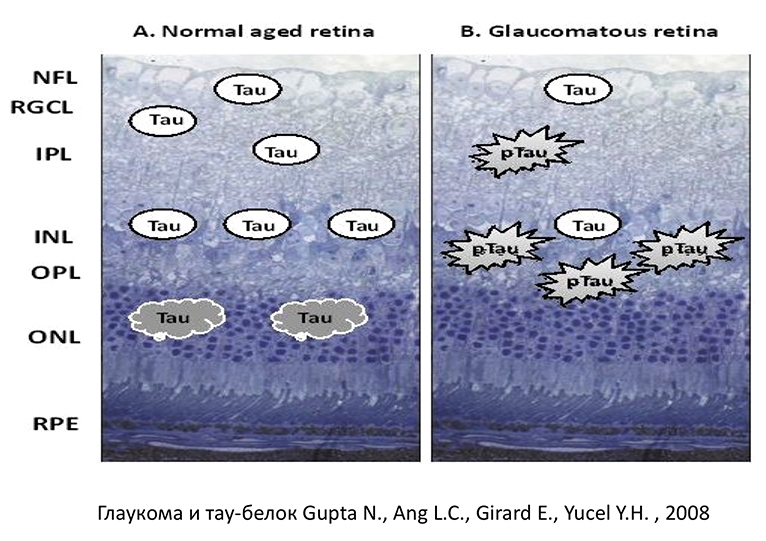
Рис.13
Мы в свою очередь провели иммуногистохимический анализ срезов НКТ на патологические бета-амилоид и тау-белок у пациента с глаукомой. Было установлено иммунопозитивное преимущественно цитоплазматическое окрашивание крупных нейрональных клеток и клеточных элементов глии в НКТ при глаукоме (рис. 14-15). Аналогичные результаты иммунногистохимического анализа мы получили и при исследовании зрительной коры, что в свою очередь подтверждает транссинаптическое распространение патологического процесса на структуры ЦНС при глаукоме.

Рис.14

Рис.15






