Отложение -амилоидных бляшек является характерным признаком многих нейродегенеративных заболеваний. Для болезни Альцгеймера характерно отложение -амилоида в виде сенильных бляшек. В настоящее время доказана роль -амилоида в развитии апоптоза ГКС при глаукоме (рис. 3-5).
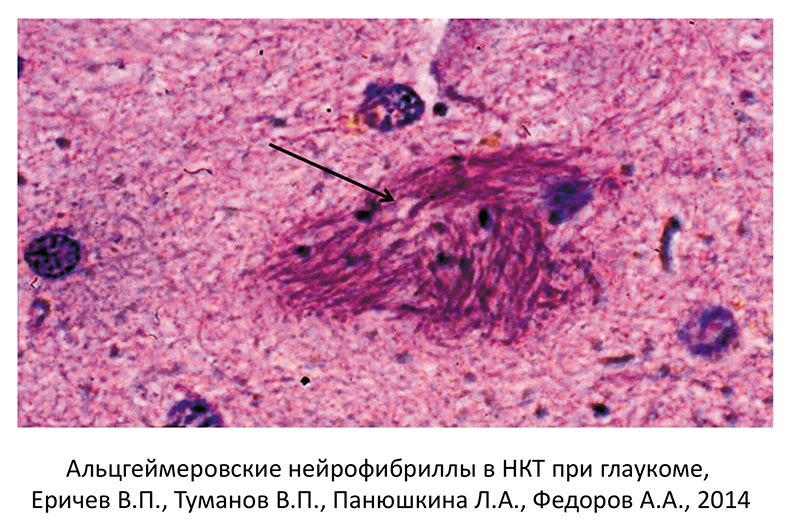
Рис. 3
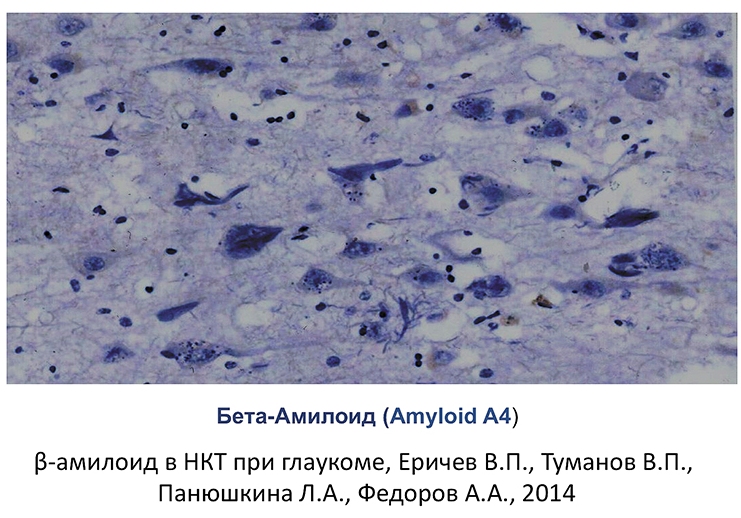
Рис. 4
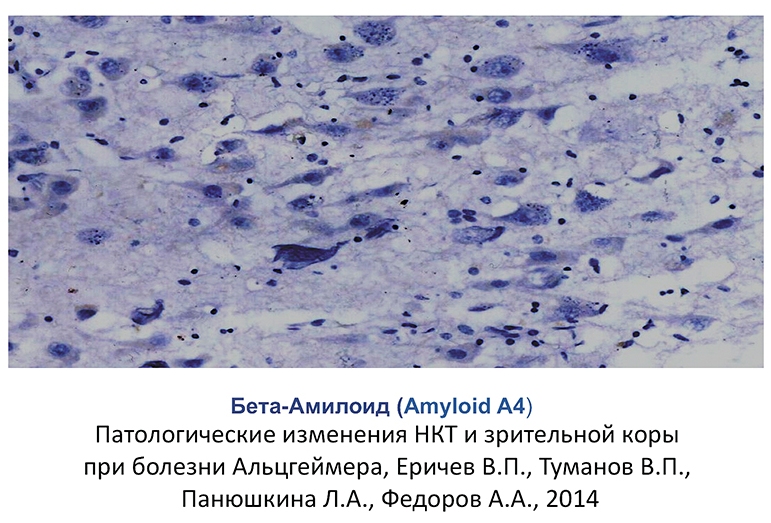
Рис. 5
В экспериментальных моделях глаукомы у крыс обнаружен патологический процесс АРР, индуцированный каспазой-3, и увеличение экспрессии -амилоида ГКС. А также выявлена сниженная концентрация -амилоида в стекловидном теле у пациентов с глаукомой (по сравнению с отложением его в сетчатке). Доказано, что экзогенный -амилоид индуцирует апоптоз ретинальных ганглиозных клеток in vivo, причем эффект этот зависит от дозировки и времени. Следует отметить, что нейротоксический эффект -амилоида более выражен и достигает своего максимума через 72 часа после воздействия высокого внутриглазного давления. В экспериментах подтверждена эффективность терапии, направленной на уменьшение отложений -амилоида и, как следствие, предотвращение апоптоза при глаукоме.
Нейротоксические свойства агрегатов -амилоида реализуются через различные механизмы. Среди них: усиление эксайтотоксических свойств возбуждающих аминокислот — глутамата и аспартата; нарушение гомеостаза ионов кальция; усиление процессов перекисного окисления липидов; индукция апоптоза и энергетическое истощение клеток. Все эти процессы взаимосвязаны, но, по крайней мере, в первых двух непосредственное участие принимает глутаматэргическая система, а два других реализуются с участием последней.
Глутамат — это аминокислота, которая является одним из главных возбуждающих нейротрансмиттеров в ЦНС человека. Действие этой аминокислоты опосредуется NMDA-рецепторами. При избыточном накоплении глутамата в клетке активируется апоптический каскад вследствие повышенного поступления ионов Са++, увеличения продукции свободных радикалов и активации каспаз. Это процесс получил название эксайтотоксичности — пускового механизма некротической и апоптической нейрональной смерти при многих нейродегенеративных заболеваниях.
Гиперстимуляция глутаматэргической системы принимает участие и в механизмах гибели ГКС при глаукоме. В 1957 году Lucas и Newhouse первыми описали токсическое действие глутамата на глаз млекопитающих. Подкожное введение глутамата молодым мышам приводило у животных к значительной деструкции внутренних слоев сетчатки, особенно ганглиозного слоя. Olney продемонстрировал глутамат-индуцированную токсичность у новорожденных мышей и ввел термин «эксайтотоксичность» для описания этого процесса. Sisk и Kuwabara вводили глутамат интравитреально взрослым кроликам-альбиносам и наблюдали дегенерацию во внутреннем нуклеарном и ганглионарном слоях. Azuma отмечал глубокую экскавацию диска зрительного нерва у новорожденных крыс, которым вводили глутамат. Dreyer в 1996 году, выполняя экстракцию катаракты пациентам с ПОУГ, одним из первых описал повышение концентрации глутамата в стекловидном теле. Автор отмечает, что высокая концентрация глутамата может быть отнесена к одним из наиболее ранних признаков глаукомы, так как выявлялась у пациентов с сохранными полями зрения. И хотя на настоящий момент результаты этой работы подвергаются большому сомнению, дальнейшие исследования в этой области продолжаются. Многочисленные исследования ЦНС подтвердили, что глутамат в концентрации 2-5 ммоль/л становится опасным для нейронов гиппокампальной и парагиппокампальной областей, а для ретинальных ганглионарных клеток эта концентрация может оказаться летальной. Глутамат индуцирует их селективную гибель при глаукоме в культуре клеток свиньи, в то время как другие нейроны остаются интактными. Схожие результаты были получены и для сетчатки кроликов. Токсический эффект глутамата описан при болезни Альцгеймера.
На понимании этих процессов основано применение в лечении болезни Альцгеймера и болезни Паркинсона блокаторов NMDA-рецепторов, например мемантина. Y. Yucel и N. Gupta в 1996 году в эксперименте на обезьянах подтвердили защитное действие мемантина на нейроны наружного коленчатого тела и предотвращение транссинаптической атрофии при глаукоме. Несмотря на это, рандомизированное контролируемое исследование эффективности мемантина в качестве нейропротектора при глаукоме не дало убедительных положительных результатов.
Результаты нашей работы по изучению эффективности мемантина при прогрессировании ГОН подтвердили эти выводы. Под нашим наблюдением находились 16 пациентов (27 глаз) с различными стадиями ПОУГ с нестабилизированным течением на фоне компенсированного ВГД. Нормализация офтальмотонуса была достигнута путем подбора эффективной гипотензивной терапии или в результате хирургического вмешательства. О компенсации ВГД судили по данным динамической двунаправленной аппланации роговицы.
У всех пациентов, принимавших участие в клиническом исследовании, за 3 месяца до назначения им мемантина было зафиксировано сужение полей зрения по данным автоматизированной статической компьютерной периметрии.
Лечение мемантином начинали с назначения минимально эффективных доз с постепенным их увеличением. В течение первой недели пациенты получали 5 мг/сут (в утренние часы), в течение второй недели — 10 мг/сут (по 5 мг утром и вечером), во время третьей недели суточная доза составила 15 мг (10 мг утром и 5 мг вечером). На протяжении четвертой недели пациенты получали по 20 мг/сут (10 мг утром и вечером). Пациенты были разделены на две группы: 15 глаз были обследованы по пороговой программе 30-2 (1-я группа), 12 — по скрининговой трехзонной программе 120 (2-я группа). Оценку терапевтической эффективности мемантина осуществляли через 1 и через 2 месяца от начала лечения.
Динамика основных параметров поля зрения у пациентов 1-й группы на фоне приема мемантина отражена на рис. 6. Анализируя полученные результаты, следует отметить, что максимальная эффективность препарата отмечена сразу по окончании курса лечения. Так, суммарная светочувствительность ЦПЗ к концу 1-го месяца увеличилась на 9,95%, MD — на 23,6%, индекс PSD снизился на 9,87%. Спустя 2 месяца отмечена незначительная отрицательная динамика показателей центрального поля зрения, хотя значения MD и суммарной светочувствительности все еще остаются выше исходных.
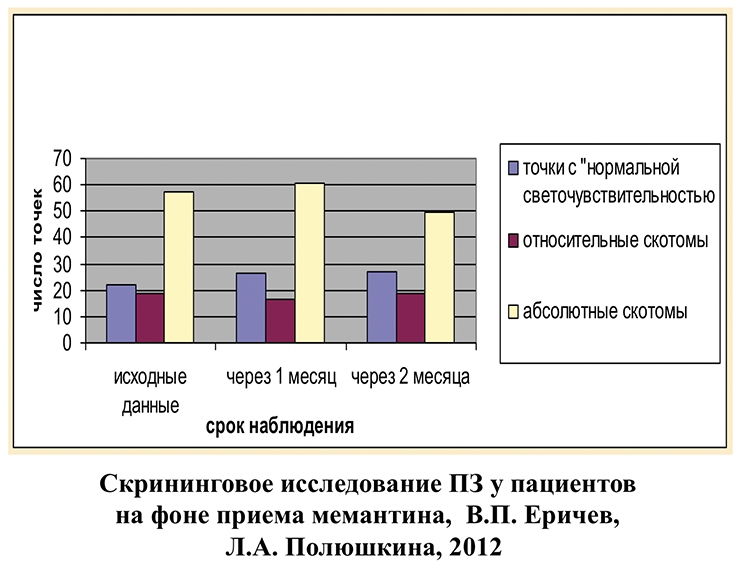
Рис. 6






