В.П. Еричев, В.П. Туманов, Л.А. Панюшкина, А.А. Федоров
ФГБНУ «НИИГБ»
Глаукома — одна из наиболее важных медико-социальных проблем современной офтальмологии. Это заболевание занимает одно из ранговых мест среди причин необратимой слепоты и слабовидения. По данным H. Quigly, общее число больных глаукомой в мире к 2020 г. возрастет с 60 до 80 млн человек, а слепота вследствие этого заболевания увеличится с 8,4 до 11,2 млн человек. В России доля глаукомы в нозологической структуре слепоты и слабовидения возросла за 5 лет с 14 до 29% (Либман Е.С. с соавт.).
Столь угрожающая статистика свидетельствует о серьезных трудностях, связанных как с пониманием природы, так и с диагностикой и лечением этого заболевания.
Долгое время глаукому рассматривали лишь как глазное заболевание, основным фактором риска которого является повышенное внутриглазное давление. И действительно, в патогенезе глаукомы ведущую роль занимает гибель ганглиозных клеток сетчатки и их аксонов под воздействием высокого ВГД.
Однако, несмотря на эффективные терапевтические и хирургические методы, направленные в основном на нормализацию внутриглазного давления, у каждого пятого пациента с глаукомой продолжается распад зрительных функций, что является неопровержимым свидетельством глаукомы как многофакторного заболевания. На настоящий момент неоспоримым становится факт существования механизмов развития глаукомной оптической нейропатии (ГОН), независящих напрямую от уровня внутриглазного давления. Основные механизмы прогрессирования ГОН (механическая, сосудистая, метаболическая, аутоимунная) усматривают некоторые общие признаки с нейродегенеративными заболеваниями.
Известно, около 70% волокон зрительного тракта, формируя ретиногеникулярные пути, заканчиваются в наружном коленчатом теле (НКТ), которое рассматривали лишь как «ретрансляционную станцию», передающую информацию от нейронов сетчатки через зрительную лучистость коре головного мозга. В настоящее время показано, что на уровне НКТ происходит довольно существенная и разноплановая обработка зрительной информации. В составе НКТ проходят зрительные пути — магноцеллюлярный, парвоцеллюлярный и кониоцеллюлярный.
Магноцеллюлярный путь обеспечивает регистрацию движения объектов, восприятие пространственной глубины и определение пространственных отношений. Нейроны этого пути проецируются на 1 и 2 слои НКТ. Парвоцеллюлярный путь служит для анализа информации о контурах объекта и линейной ориентации его деталей, а также для формирования зрительного представления о цвете объекта, а именно отвечает за информацию об оттенках красного и зеленого цветов. Формируют этот проводящий путь нейроны 3-6 слоев НКТ. Кониоцеллюлярный путь отвечает за сине-желтый процессинг. Его нейроны располагаются между 1 и 2 , 2 и 3 слоями, а также в S-слое кпереди от 1 слоя.
Слои 1, 4 и 6 НКТ получают афферентные импульсы от контрлатерального глаза, а слои 2, 3 и 5 — от ипсилатерального глаза.
В наружном коленчатом теле выделяют две популяции нейронов — вставочные и проводящие. Аксоны первых оканчиваются в самом НКТ, а аксоны вторых идут к первичной зрительной коре.
В литературе появляются единичные сведения, рассматривающие глаукому как заболевание, занимающее некое промежуточное положение между неврологической и офтальмологической патологией. Современные исследования обнаруживают сходство между глаукомой и нейродегенеративными заболеваниями, в частности болезнью Альцгеймера.
Уже в общепринятых определениях болезни Альцгеймера и ПОУГ можно найти много общего.
ПОУГ — это хроническая прогрессирующая оптическая нейропатия, которая объединяет группу заболеваний с характерными морфологическими изменениями головки зрительного нерва (экскавация) и слоя нервных волокон сетчатки при отсутствии другой офтальмопатологии и врожденных аномалий. Для данного заболевания характерны прогрессирующая гибель нейронов сетчатки и возникновение дефектов поля зрения.
Болезнь Альцгеймера — это хроническое, прогрессирующее нейродегенеративное заболевание, характеризующееся расстройством памяти и когнитивной дисфункцией. В патогенезе заболевания ведущую роль занимает гибель нейронов и синаптических связей в коре головного мозга и определенных субкортикальных областях.
Интересны и другие факты. По данным A.U. Bayer (2002), частота встречаемости глаукомы у пациентов с болезнью Альцгеймера составляет 25,9%, в то время как в контрольной группе этот показатель равен 5,2%. Обнаружены дефекты полей зрения у пациентов с болезнью Альцгеймера, напоминающие картину глаукомного поражения зрительных функций (Trick G.L., 1995). В опубликованных исследованиях описаны и некоторые общие механизмы развития этих двух заболеваний.
Все нейродегенеративные заболевания объединяют несколько общих признаков: тенденция к прогрессированию с медленной потерей функций; селективная потеря определенных популяций нейронов в результате апоптоза; транссинаптическая дегенерация (первичная, вторичная); общие механизмы клеточной смерти — оксидативный стресс и глутаматная токсичность.
Болезнь Альцгеймера характеризуется гибелью нейронов в результате апоптоза и потерей синаптических связей в коре головного мозга и определенных субкортикальных областях, что в свою очередь приводит к выраженной атрофии и дегенерации височных и теменных долей.
Гибель ГКС при глаукоме, по данным H.A. Quigley, также происходит в результате апоптоза. Повышенное ВГД приводит к деформации перегородок решетчатой пластинки, что вызывает компрессию аксонов ганглиозных клеток.
В результате снижения аксоплазматического тока и ретроградного аксонального транспорта нарушается поступление нейротрофических факторов к телу ГКС. Их недостаток запускает механизм апоптоза. Апопотоз в этом случае идентифицирован по следующим специфическим признакам: конденсации хроматина, дроблению геномной ДНК, обнаружению апоптозных телец.
Современные методики позволяют наблюдать это процесс in vivo. Так профессором Cordeiro (2004) был разработан метод DARC (detection of apoptosing retinal cells) (рис. 1). С помощью лазерного офтальмоскопа и флуоресциновой метки можно прижизненно наблюдать свечение ГКС, находящихся в стадии апоптоза.
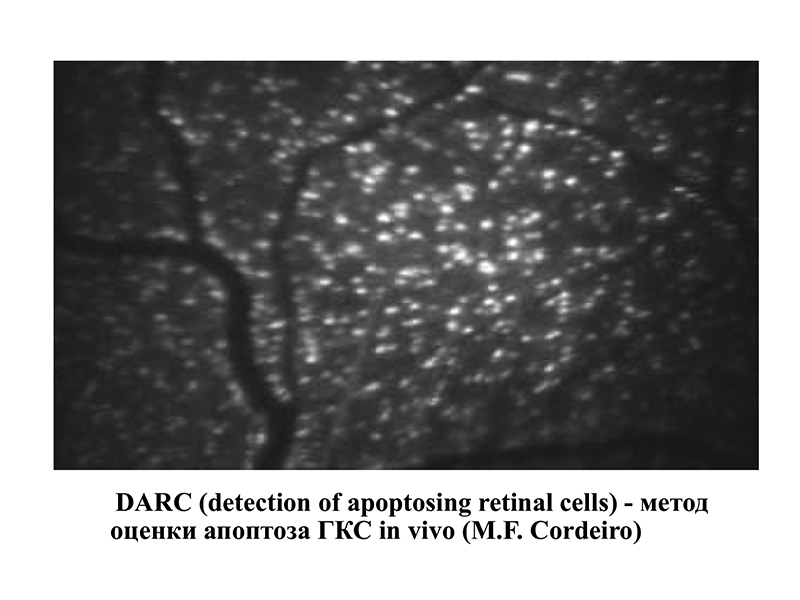
Рис. 1
Апоптоз — запрограммированная гибель клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода ее содержимого в окружающую среду. Ключевую роль в индукции апоптоза играет активация каспаз-ферментов, расщепляющих белки по остаткам аспартата. При взаимодействии инициирующих и эффекторных каспаз запускается каскад реакций, в результате которого происходит деструкция белков цитоскелета и регуляторных белков ядра, разрушаются структурные белки ядра — происходит фрагментация ДНК. При изучении образцов головного мозга больных, умерших от болезни Альцгеймера, обнаружен более высокий уровень активированных каспаз в клетках микроглии. В экспериментальной модели глаукомы у крыс также обнаружено повышение концентрации активированных каспаз: каспазы-3 и каспазы-8. Каспаза-3 — главный эффектор апоптического каскада — активируется в ГКС и расщепляет АРР (англ. Amyloid Precursor Protein) до нейротоксических фрагментов, включающих в себя -амилоид. Каспаза-8 принимает участие в апоптозе посредством активации рецепторов к фактору некроза опухоли (рис. 2).
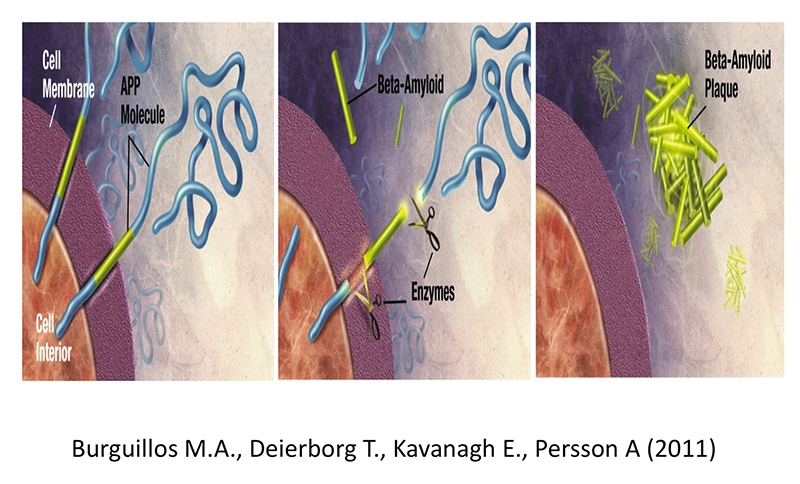
Рис. 2






