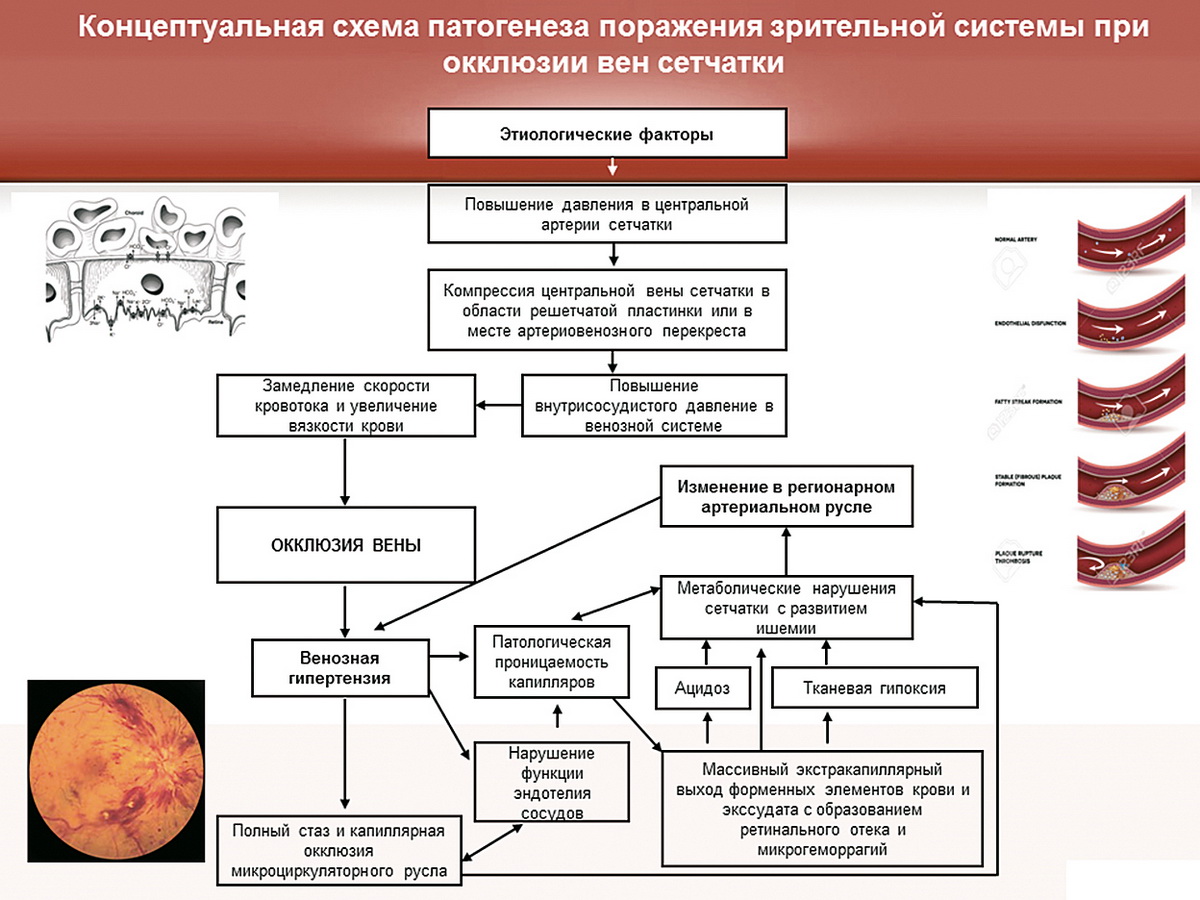
Окклюзию вен сетчатки можно представить в виде схемы (рис. 2). Определенные этиологические факторы повышают давление в центральной артерии сетчатки, возникает компрессия вены в области решетчатой пластинки или артерио-венозного перекреста — происходит повышение внутрисосудистого давления в венозной системе, возникает венозный стаз и венозная гиперемия, окклюзия вены, усиление венозной гипертензии, возникает полный стаз и капиллярная неперфузия; капиллярная неперфузия приводит к нарушению эндотелия сосудов, возникает их патологическая проницаемость, которая сопровождается массивной экстравазацией форменных элементов крови и экссудата с образованием ретинального отека и микрогеморрагий. Эти процессы сопровождаются ацидозом и тканевой гипоксией, метаболическими нарушениями сетчатки с развитием ишемии; в процесс включаются изменения в артериальном русле, т.е. запускается порочный круг, когда венозная недостаточность приводит к артериальной, которая в свою очередь усугубляет венозные изменения. Когда мы видим эту схему, понимаем, что локальное воздействие, как правило, неэффективно. Мы не можем справиться с помощью антиглаукомной операции, сосудистой терапии. Нам необходимо разорвать порочный круг на любом из этапов его формирования. Таким образом, начальным субстратом неоваскулярной глаукомы можно считать окклюзию ретинальных вен.
Если мы говорим об основном субстрате неоваскулярной глаукомы, то это — неоваскуляризация. Неоваскуляризация — это абсолютно физиологический процесс; в процессе формирования органов неоваскуляризация необходима. Ангиогенез — это процесс, позволяющий восстановиться поврежденным тканям, но при глазных заболеваниях неоангиогенез (нео-васкуляризация) оказывает разрушительный эффект. Рост новых сосудов детерминирован балансом между его стимуляторами и ингибиторами. Если превалирует одно из этих звеньев, наступает болезнь. Только в случае, когда ингибиторы и стимуляторы находятся на одном уровне, идет процесс нормальной васкуляризации.
При неваскулярной глаукоме и при постокклюзионных изменениях механизмы ангиогенеза ничем не отличаются от других механизмов ангиогенеза. В их основе всегда лежит гипоксия, затем происходит выброс ангиогенных факторов; одним из ключевых факторов является сосудисто-эндотелиальный фактор роста; кроме того, это могут быть факторы роста тромбоцитов, инсулинозависимый фактор; подключаются провоспалительные цитокины и химокины; могут быть такие неспецифические вещества, как матричные металлопротеиназы. Смысл заключается в том, что идет стимуляция эндотелия с его пролиферацией, с формированием новообразованных сосудов и их ремодулированием. Этот процесс одинаков для всех ишемических и любых альтераций ткани.
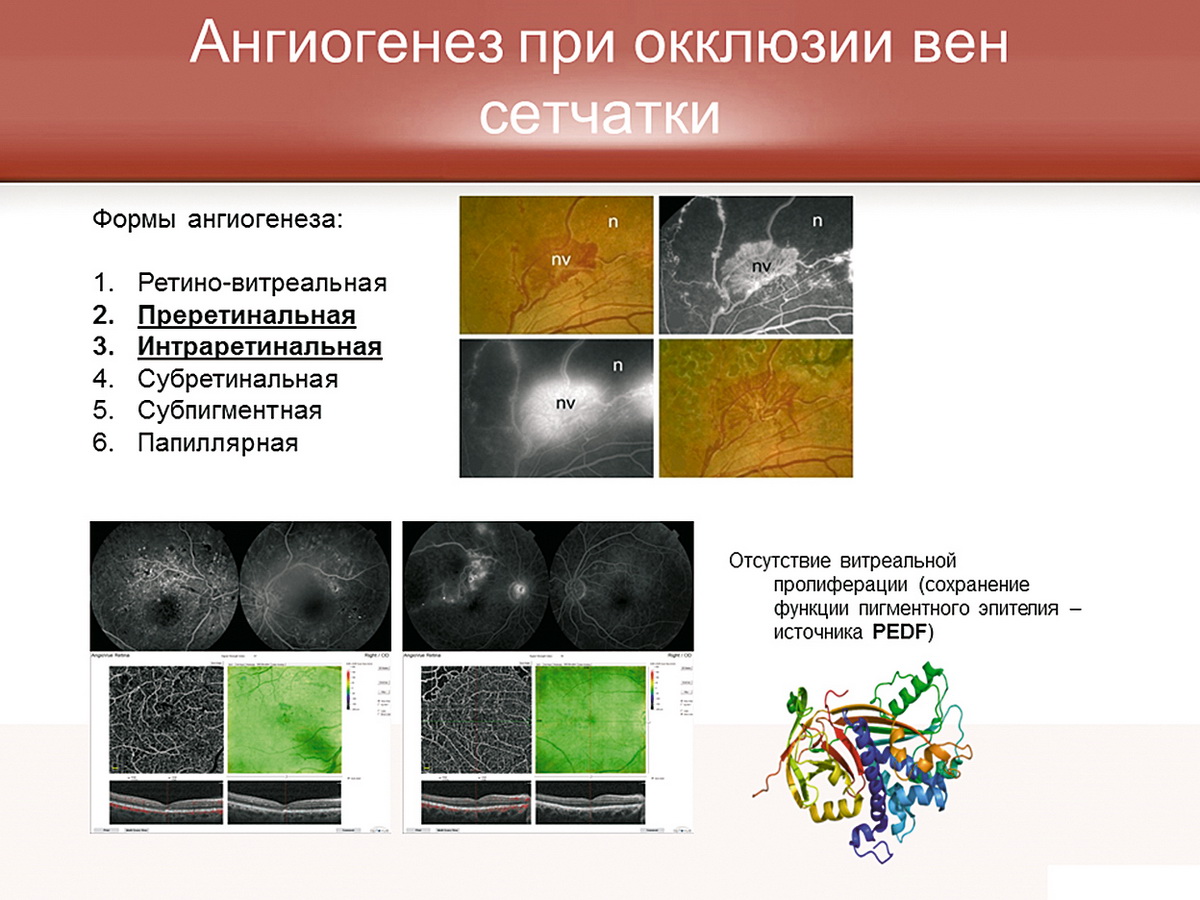
Однако при тромбозе существуют свои особенности ангиогенеза. Из существующих, в соответствии с сегодняшней классификацией, шести форм глазного ангиогенеза при тромбозах преимущественно встречаются две формы: преретинальная и интраретинальная неоваскуляризация. Вспомним наших пациентов с тромбозом и сахарным диабетом. При тромбозе мы практически никогда не видим витреальной пролиферации в отличие от сахарного диабета. Почему это происходит? Мы знаем, что, кроме стимуляторов ангиогенеза, существуют ингибиторы. Основным ингибирующим фактором является фактор PEGF, который продуцируется пигментным эпителием сетчатки. На рис. 3 представлен клинический пример двух пациентов: пациент с сахарным диабетом, у которого практически тотально разрушен пигментный эпителий, и пациент с серьезной окклюзией ретинальных вен, но с неизмененным пигментным эпителием. То есть при окклюзии ретинальных вен продолжается продукция фактора PEDF, который защищает стекловидное тело от пролиферации и не дает фактору VEGF концентрироваться в стекловидном теле, что случается, например, при сахарном диабете. Но VEGF выделяется, и ему нужно куда-то попасть, и вместо стекловидного тела он скапливается во внутриглазной влаге и затем диффундирует во влагу передней камеры. Возможно, именно поэтому неоваскуляризация при диабете — это, в принципе, конец. Тогда как неоваскуляризация при окклюзии — это ранние процессы; у некоторых пациентов мы видим неоваскуляризацию переднего отрезка через неделю после свершившейся окклюзии.
Итак, чтобы запустился процесс неоваскуляризации переднего отрезка глаза, концентрация фактора VEGF во влаге передней камеры должна составлять более 1000 мкг/мл, что практически в 10 раз выше нормальной концентрации, при этом порог регрессии составляет около 400 мкг/мл. Таким образом, чтобы добиться регрессии необходимо в 5 раз снизить уровень VEGF. Возможно, это является объяснением кратковременности эффекта одной или двух инъекций анти-VEGF. Эта теория была подтверждена исследованиями на приматах, которым в стекловидное тело вводился фактор VEGF в концентрациях, необходимых для запуска неоваскулярной глаукомы, в результате чего происходила неоваскуляризация переднего отрезка глаза.
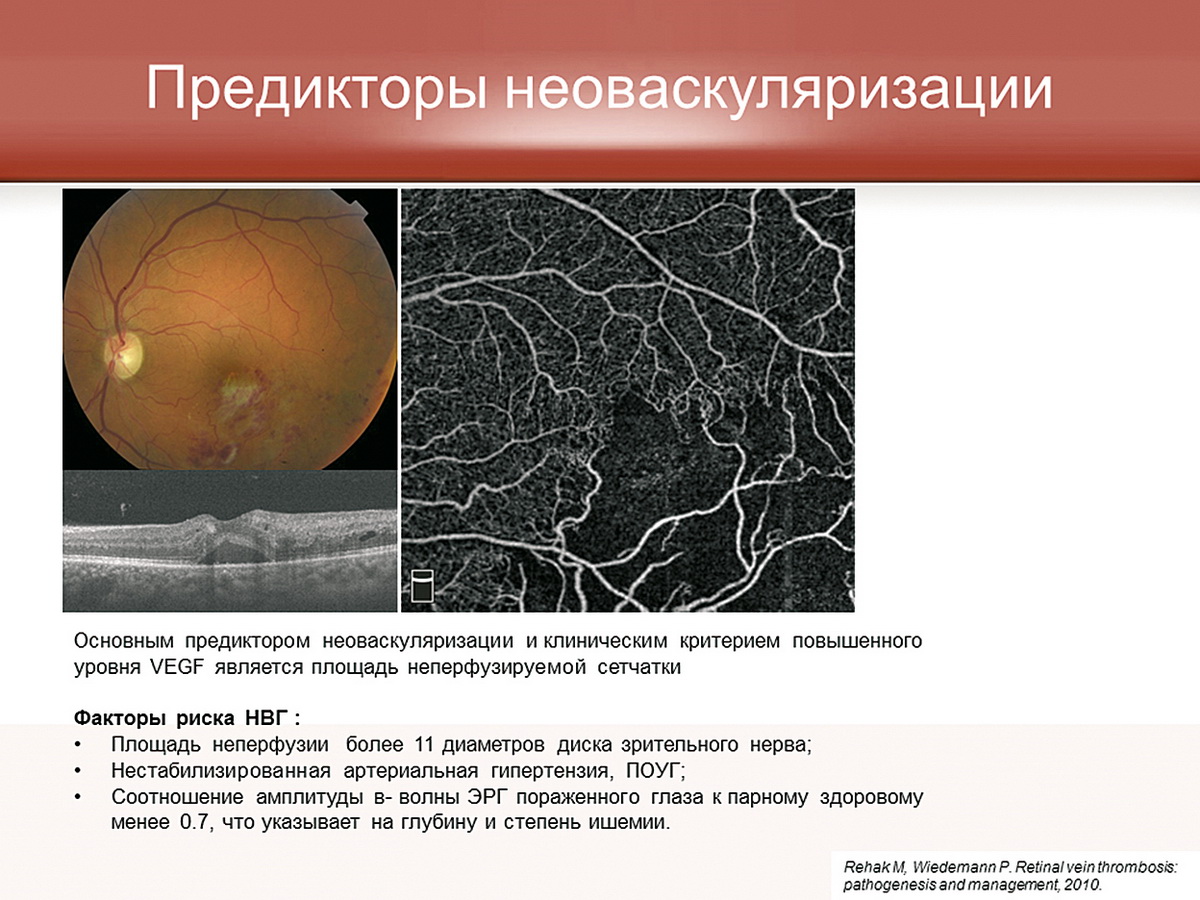
Исследования, которые проводились в нашей клинике (мы исследовали не неоваскулярную глаукому, а макулярный отек, возникающий после окклюзий), подтвердили эти данные. Было показано, что фактор VEGF во влаге передней камеры у пациентов с окклюзией повышается до уровня более 1000 мкг/мл. Но, кроме фактора VEGF, в процессе участвуют противовоспалительные цитокины, химокины, т.е. это такой мощный каскад реакций, который нельзя объяснить лишь только одним фактором VEGF. Неоваскулярная глаукома все-таки ассоциируется с тромбозом центральной вены сетчатки. Но нельзя благодушно относиться и к окклюзии ретинальных ветвей, т.к. уровень VEGF при окклюзии ретинальных ветвей в некоторых случаях также достигает критических значений, и мы нередко наблюдаем при достаточно благоприятной картине глазного дна через некоторое время формирование неоваскулярной глаукомы. Конечно, мы не можем у каждого пациента брать влагу передней камеры, чтобы определить, будет ли здесь неоваскулярная глаукома или нет. Мы всегда ищем клинические критерии, которые могли бы служить прогнозом возможной неоваскуляризации. Основным предиктором неоваскуляризации и клиническим критерием повышенного уровня VEGF является площадь неперфузируемой сетчатки. К факторам риска неоваскулярной глаукомы относится площадь капиллярной неперфузии более 11 диаметров диска зрительного нерва. Я специально поставила фотографию нашего пациента (рис. 4) с окклюзией ветви центральной вены сетчатки. Офтальмоскопическая картина достаточно благоприятна, но ОКТ-ангио указывает на значительные зоны неперфузии в центральном отделе, а ФАГ показывает, что зона неперфузии составляет практически 14 диаметров диска. Кроме того, к факторам риска, способным запустить процесс неоваскуляризации переднего отрезка глаза, относится нестабилизированное артериальное давление и ПОУГ.
Я не буду останавливаться на том, как ПОУГ влияет на этот процесс, но эти факторы могут перевести неишемическую форму тромбоза через 2-4-6 месяцев в настоящую ишемическую постокклюзионную ретинопатию. Для оценки степени ишемии можно использовать электроретинографические исследования — соотношение амплитуды b-волны больного глаза к здоровому: показатель менее 0,7 указывает на глубокие ишемические изменения ретинальной ткани.
Отдельно следует остановиться на особенностях неоваскуляризации переднего отрезка глаза, к которым относятся рубеоз радужки и неоваскуляризация угла передней камеры. Известно, что неоваскуляризация переднего отрезка глаза, в частности, радужки, проходит 3 стадии (рис. 5): первая, достаточно длительная — дилятация собственных сосудов, что сопровождается нарушением проницаемости сосудистой стенки, происходит экстравазация флюоресцеина из нормальных сосудов радужки, затем при определенных условиях возникает рубеоз радужной оболочки. Считается, что в 88% случаев неоваскуляризация переднего отрезка глаза начинается с рубеоза зрачкового края и только в 12% случаев неоваскуляризация передней камеры предшествует рубеозу. Когда я готовилась к конференции, нашла данные, ставшие для меня открытием.