Второй этап – ФЭК через 2 недели. Послеоперационный период проходил ареактивно; ВГД – на дооперационном уровне; МКОЗ: исходная – 0,35, на первый день – 0,69, через 1 месяц – 0,85.
Полученные результаты доказывают, что мЦФК в режиме плотности потока F = 121,8 Дж/см² можно отнести к эффективному, безопасному и предсказуемому методу лечения. Последовательная хирургия с мЦФК на первом этапе и ФЭК ‒ на втором характеризуется высокими функциональными результатами и минимальным риском осложнений у пациентов с коморбидной патологией.
Д.м.н. Н.Н. Арестова (Москва) от группы авторов выступила с докладом «Роль ИАГ-лазерной хирургии в лечении глаукомы у детей». Детская глаукома – гетерогенная группа заболеваний, которая характеризуется развитием офтальмогипертензии, повреждением структур глазного яблока, обусловленных повышенным ВГД, относится к разряду рефрактерных глауком. При отсутствии ранней диагностики и адекватного лечения ведет к необратимому снижению зрения и ранней инвалидизации детей. В структуре детской слепоты детская глаукома составляет в разных странах от 4 до 15%. Первичная врожденная глаукома встречается редко – 1 случай на 10-70 тысяч новорожденных, но является причиной 5% детской слепоты в мире.
Классификация детской глаукомы: А. Первичная детская глаукома: 1. Первичная врожденная глаукома; 2. Ювенильная ОУГ. Б. Вторичная врожденная глаукома: 1. Глаукома, ассоциированная с врожденными аномалиями развития глаз (аномалия Аксенфельда-Ригера, аномалия Петерса, аниридия, эктопия хрусталика, ППГСТ и др.); 2. Глаукома, ассоциированная с врожденными системными заболеваниями или синдромами (синдром Дауна, синдром Стерджа-Вебера, синдром Лоу и др.); 3. Глаукома, ассоциированная с приобретенными состояниями: травмы, увеит, РН, после удаления катаракт, опухоль.
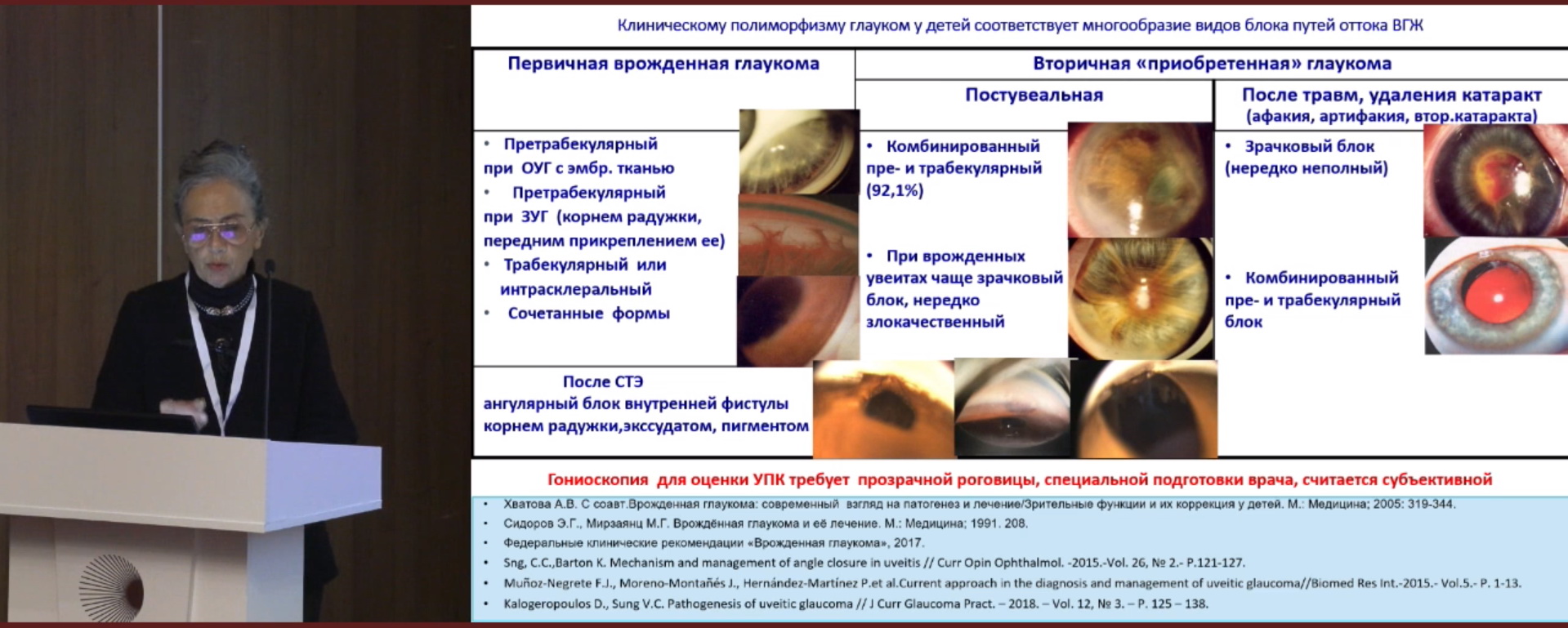
Клинический полиморфизм глауком у детей объясняет многообразие блоков путей оттока ВГЖ (рис. 1). Среди современных объективных методов визуализации переднего отдела глаза при детских глаукомах автор отметила ультразвуковую биомикроскопию (УЗБ) (возможна при помутнении роговицы, но контактна, требует наркоза младенцам), оптическую когерентную томографию (ОКТ) (бесконтактна, возможно применение без наркоза, невозможно применение при помутнении роговицы).
Достоверными особенностями первичной врожденной глаукомы (ПВГ) по данным УЗБ и ОКТ по сравнению со здоровыми глазами являются: более широкий УПК, менее толстая радужка, более узкий или отсутствует шлеммов канал, частые аномальные тканевые мембраны, покрывающие трабекулярнуя сеть, часто аномальное прикрепление радужной облочки и цилиарного тела; ширина носового и височного сегмента УПК больше, толщина радужки снижена, шлеммов канал идентифицирован в 15,4% ПВГ, трабекулярная сеть идентифицирована у 34,6% при ПВГ, гиперрефлективная преангулярная мембрана у 19,2%, высокое прикрепление радужки в 100%.
Автор обратила на особую важность ОКТ для оценки послеоперационных изменений после ангулярной хирургии при ПВГ.
Лечение детских глауком – хирургическое кроме случаев юношеской ОУГ. В XXI веке сфера «ангулярных» операций расширилась: трабекулотомии с микрокератомом с подсветкой, эндоскопические гониотомии, фотодеструктивная гониотомия, однако, основным, традиционным и эффективным методом лечения является синустрабекулэктомия и ее модификации с использованием дренажей, цитостатиков и пр. хирургия детской глаукомы чревата высокой частотой неудач и осложнений.
Причины неэффективности и осложнений антиглаукомных операций у детей: искаженная анатомия глаз детей раннего возраста с глаукомой – буфтальм, растяжение лимба – ведут к ошибкам выбора места СТЭ на растянутых глазах; тонкость склеры, стафиломы – сложность формирования склерального лоскута, риск перфорации склеры, сложности ушивания лоскута; низкая жесткость склеры, анатомические особенности вторичных глауком и последствий прежних операций – предрасположенность к хирургическим и послеоперационным осложнениям (мелкая передняя камера, склонность к гипотонии, субатрофии глаза); «агрессивная реакция заживления», выраженная экссудация, пролиферация – заращение созданных путей оттока ВГЖ, колобом радужки, ангулярные сращения; аметропия, амблиопия – причина низких функциональных результатов.
Д.м.н. Н.Н. Арестова привела анализ опыта более 900 лазерных операций при детских глаукомах отдела патологии глаз у детей ФГБУ «НМИЦ ГБ им. Гельмгольца». Возраст: от 2 до 17 лет; 69% операций выполнены под наркозом. Использованы комбинированные лазерные установки. Деструктор – неодимовый ИАГ-лазер (1064 нм), для коагуляции радужки и сосудов – аргоновый или диод-лазер (532 нм).
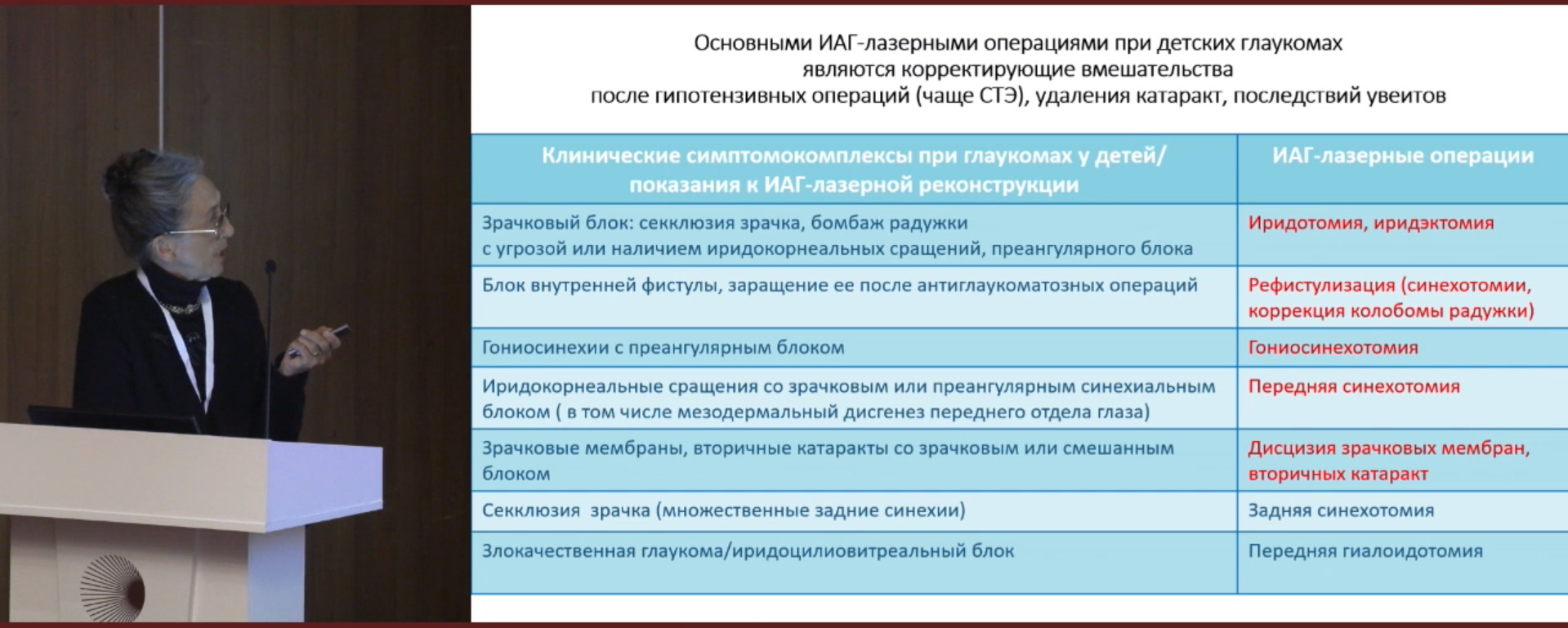
Наблюдение за детьми в отдаленные сроки (от 6 мес. до 15 лет) после реконструктивных лазерных операций при глаукомах подтвердило безопасность операций и стойкий высокий анатомо-реконструктивный и гипотензивный эффект. Определен перечень основных клинических симптомокомплексов при глаукомах различной этиологии, подлежащих реконструктивной ИАГ-лазерной хирургии у детей (рис. 2). Автор обратила внимание на особую эффективность ИАГ-лазерных вмешательств при зрачковом блоке (секклюзия зрачка, бомбаж радужки с угрозой или наличием иридокорнеальных сращений, преангулярного блока). Срочная ИАГ-лазерная иридэктомия применяется для восстановления тока ВГЖ из задней камеры в переднюю, профилактики иридокорнеальных сращений, помутнения роговицы, вторичной глаукомы.
Запатентованный дифференцированный способ лазерной ИЭ при зрачковом блоке у детей с эндогенными увеитами с учетом особенностей радужки и реакции глаз на воздействие разных видов лазерного излучения (ИАГ, диод) обеспечивает реконструктивный эффект в 95%, гипотензивный – в 85%. Способ атравматичен, уменьшает частоту кровоизлияний, экссудативно-пролиферативного синдрома, заращения колобом.
Востребованной операцией является ИАГ-лазерная рефистулизация. Применяется для рассечения иридотрабекулярных сращений, гониосращений, отсечения ущемленной радужки, перфорации фиброзной пленки в зоне фистулы. Сочетание расфокусированного и фокусированного излучения ИАГ-лазера эффективно и атравматично освобождает просвет ВФ, обеспечивает нормальное ее функционирование и профилактику вторичного (восходящего) рубцевания путей оттока ВГЖ, созданных в ходе СТЭ. Реконструктивный эффект составляет более 88,9%, гипотензивный – 73%. Оптимальные сроки рефистулизации – до 3 месяцев после ТЭ.
Для своевременного выявления и устранения блокады внутренней фистулы важен гониоскопический или ОКТ контроль состояния фистулы от максимально ранних до поздних сроков после СТЭ вне зависимости от возраста детей.
Гониосинехотомия высокоэффективная при единичных неплоскостных свежих гониосинехиях. Передняя синехотомия эффективная при иридокорнеальных сращениях со зрачковым и преангулярном синехиальном блоке (кроме плоскостных и старых сращений).
Таким образом, клинический полиморфизм глауком у детей обусловливает многообразие видов блокады путей оттока ВГЖ. ИАГ-лазерная хирургия ‒ не является конкурентом СТЭ и другим антиглаукомным операциям, но эффективное неинвазивное малотравматичное средство коррекции осложнений гипотензивных операций (чаще СТЭ), удаления катаракт, увеитов и их последствий. Основные ИАГ-лазерные корректирующие операции эффективные при детских глаукомах: иридэктомия, рефистулизация после СТЭ (коррекция колобом радужки, синехотомии), деструкции зрачковых мембран. Опыт ИАГ-лазерной хирургии при глаукомах у детей разного возраста и у подростков позволяет рекомендовать шире внедрять эти операции в клиническую практику.
Материал подготовил Сергей Тумар
Фото Сергея Тумара