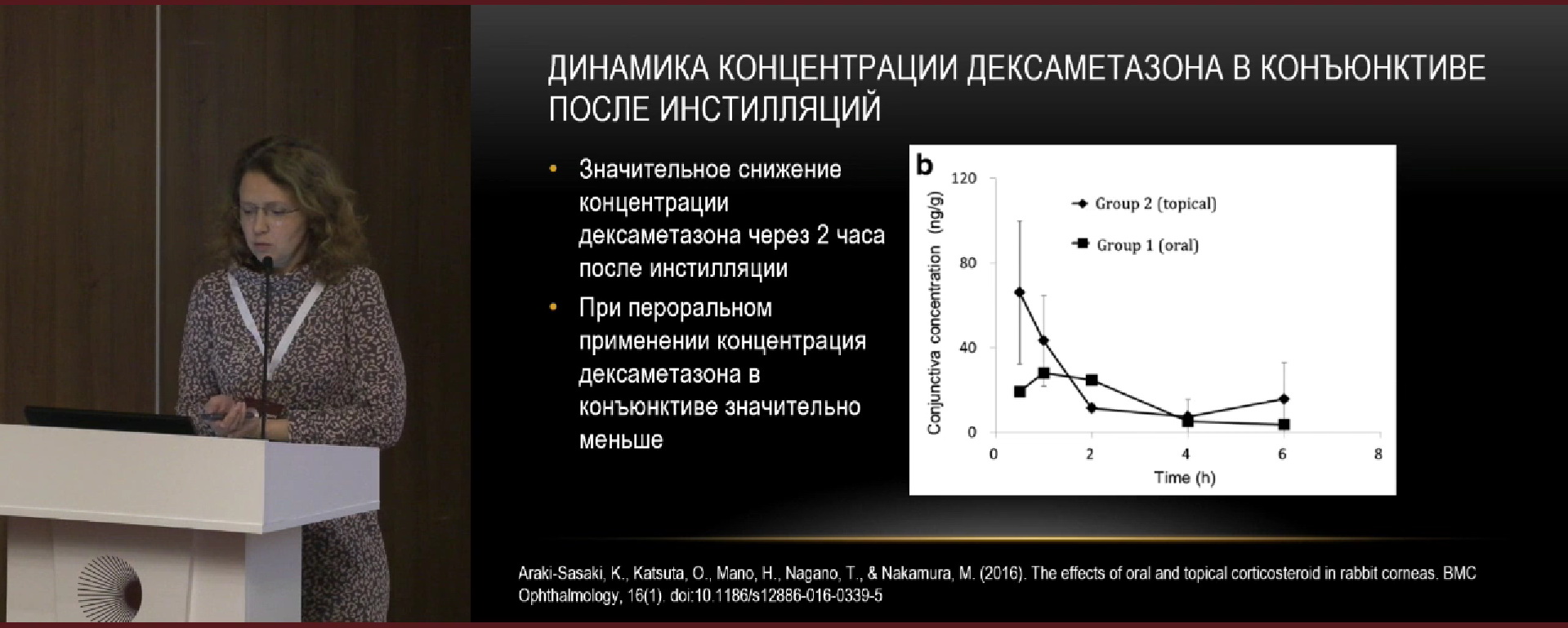
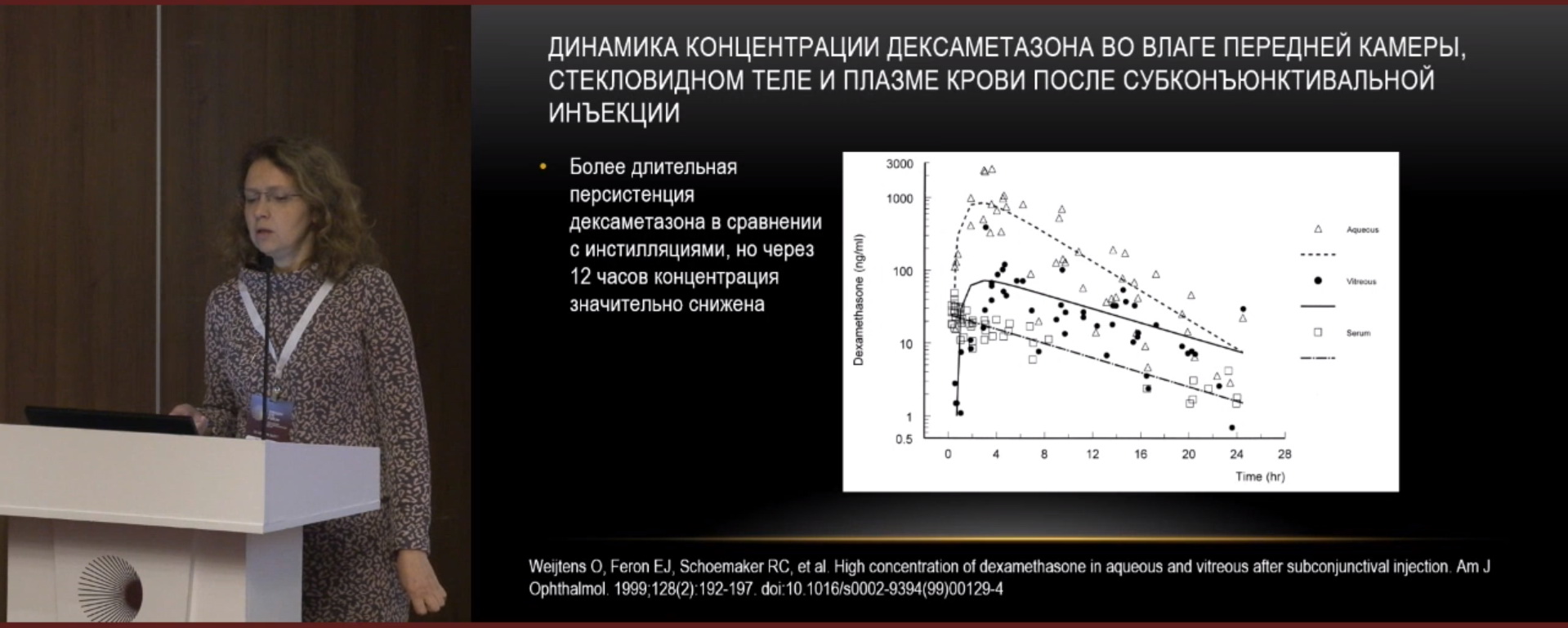
Д.м.н. Е.В. Карлова согласилась с мнением д.м.н. В.П. Николаенко, что глюкокортикоиды хорошо влияют на все фазы и факторы воспаления. Однако концентрация препарата в конъюнктиве быстро снижается после инстилляций (рис. 1), так и во влаге передней камеры, стекловидном теле и плазме крови после субконъюнктивальной инъекции (рис. 2).
По данным литературы, препарат триамцинолон после однократной интравитреальной инъекции обнаруживается во влаге передней камеры в течение 3 месяцев в концентрациях от 2152 нг/мл до 7202 нг/мл; в течение 6 месяцев – в концентрациях от 3 мкг/мл до 436 мкг/мл; и в сроки до 12 месяцев – в концентрациях от 0 до 11,2 мкг/мл.
Далее автор привела клинические примеры интраоперационного применения стероидов. В первом случае нидлинг с триамцинолоном (кеналог) и Healaflow привел формированию аваскулярной разлитой фильтрационной подушки, компенсации ВГД в течение 1,5 лет (10 мм рт. ст.) без медикаментозной поддержки. Во втором случае введение раствора триацинолона (кеналог) проведено во время операции НГСЭ в фильтрационную подушку; через 3 месяца – десцеметогониопунктура; сформирована аваскулярная разлитая фильтрационная подушка; компенсация ВГД (13 мм рт. ст.) в течение 1 года без медикаментозной поддержки.
Подводя итог, автор отметила, что в настоящее время хирургия глаукомы без специализированной антифибротической медикаментозной поддержки малоэффективна. Весьма перспективным представляется применение суспензии триамцинолона для стабилизации гипотензивного эффекта хирургии глаукомы.
К.м.н. А.В. Старостина (Москва) от группы авторов выступила с сообщением на тему «Современные методы визуализации зоны антиглаукомной операции». Среди существующих методик антиглаукомных операций наиболее часто применяются непроникающая глубокая склерэктомия + лазерная десцеметогониопунктура, синустрабекулэктомия, клапанный дренаж Ahmed, микрошунт ExPRESS.
Стандартным методом визуализации является биомикроскопия, позволяющая оценить (после непроникающей глубокой склерэктомии) фильтрационную полушку, состоятельность швов, положение склерального лоскута, глубину передней камеры, положение радужки и т.д.
После синустрабекулэктомии биомикроскопия дает возможность оценить фильтрационную подушку, размер колобомы радушки, проходимость колобомы радужки.
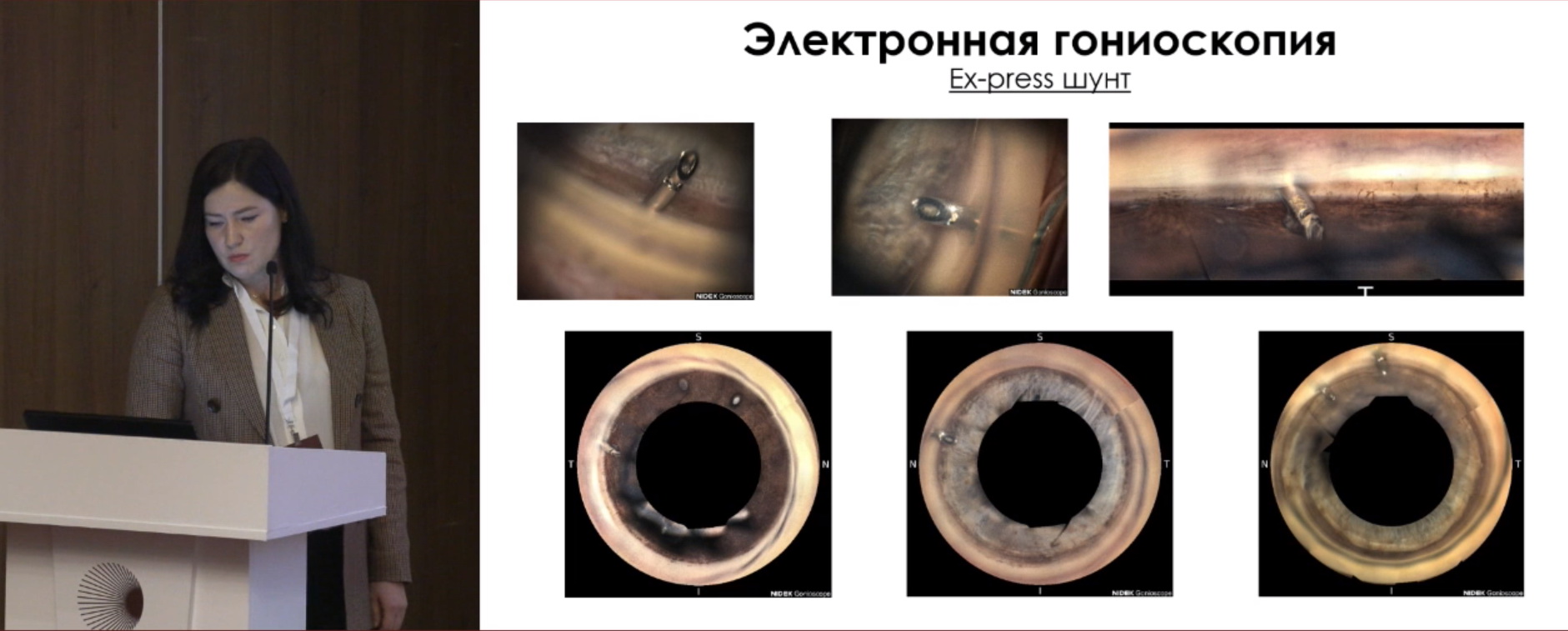
Наблюдая пациента с ExPRESS шунтом, с помощью биомикроскопии можно оценить фильтрационную подушку, положение дренажа под склеральным лоскутом, положение шунта в передней камере, проходимость дренажа (кровь, псевдоэксфолиация, пигмент и др.).
Биомикроскопия, проводимая пациенту с клапаном Ahmed, обеспечивает визуализацию дренажа в передней камере, длину трубки, дренажа в задней камере, проходимости дренажа, протрузии трубки или тела дренажа, образование капсулы вокруг тела дренажа.
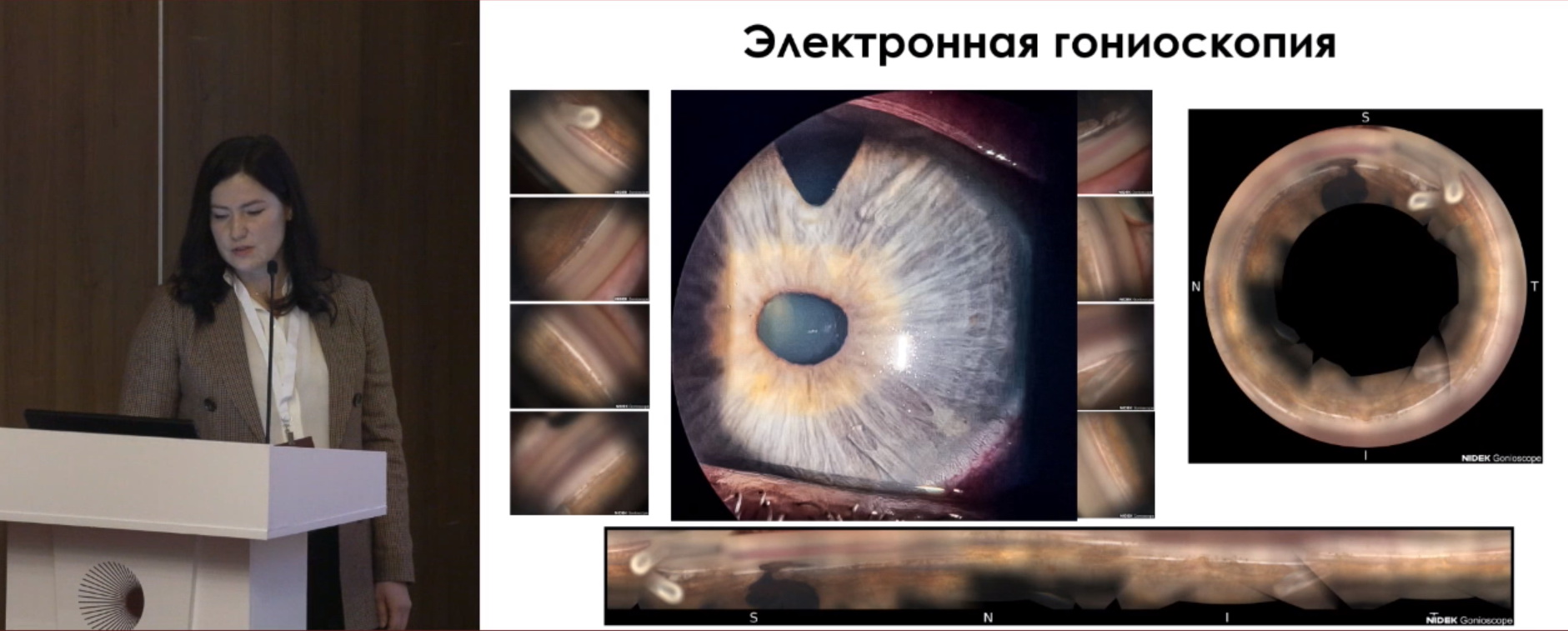
Гониоскопия представляет собой контактный субъективный метод обследования с использованием местной капельной анестезии с помощью гониолинзы, который проводится за щелевой лампой. Возможно качественно оценить ширину угла передней камеры (УПК), структуры УПК; зону НГСЭ (открытие, проминенцию трабекуло-десцеметовой мембраны (ТДМ), блокаду корнем радужки); состояние зоны СТЭК (колобому, блокирование корнем радужки); положение дренажа, проходимость дренажа; васкуляризацию УПК, синехии; наличие эмульгированного силиконового масла; новообразования и т.д.
Электронная гониоскопия. Принцип работы: гониофотографии выполняются 16-зеркальной граненой автоматически вращающейся оптической контактной линзой с встроенной цветной камерой. Каждая грань захватывает 22,5º УПК. Прибор выполняет 5 снимков с каждой грани гониолинзы – всего 80 снимков в 16 сегментах + суммарный круговой и горизонтальный снимок УПК. На рис. 1, 2 ‒ электронная гониоскопия с клапаном Ahmed, на рис. 3 – с ExPRESS шунтом. Обследование выполняется под местной капельной анестезией. Контактная среда – гель Карбомер 0,2%. Преимущества метода – возможность задокуменировать изображение УПК для дальнейшего динамического наблюдения. Недостатки: контактный метод, пациент должен четко смотреть прямо перед собой; невозможность применения при помутнениях роговицы.
Оптическая когерентная томография (ОКТ) – объективная методика визуализации структур переднего отрезка глаза. длина волны 1310 нм, до 50 000 А-сканов/сек. возможность выполнения поперечных и аксиальных сканов; качественная и количественная оценка структур переднего отрезка глаза. Бесконтактное обследование, возможно проведение при помутнениях роговицы. Ограничения – пигментный листок радужки.
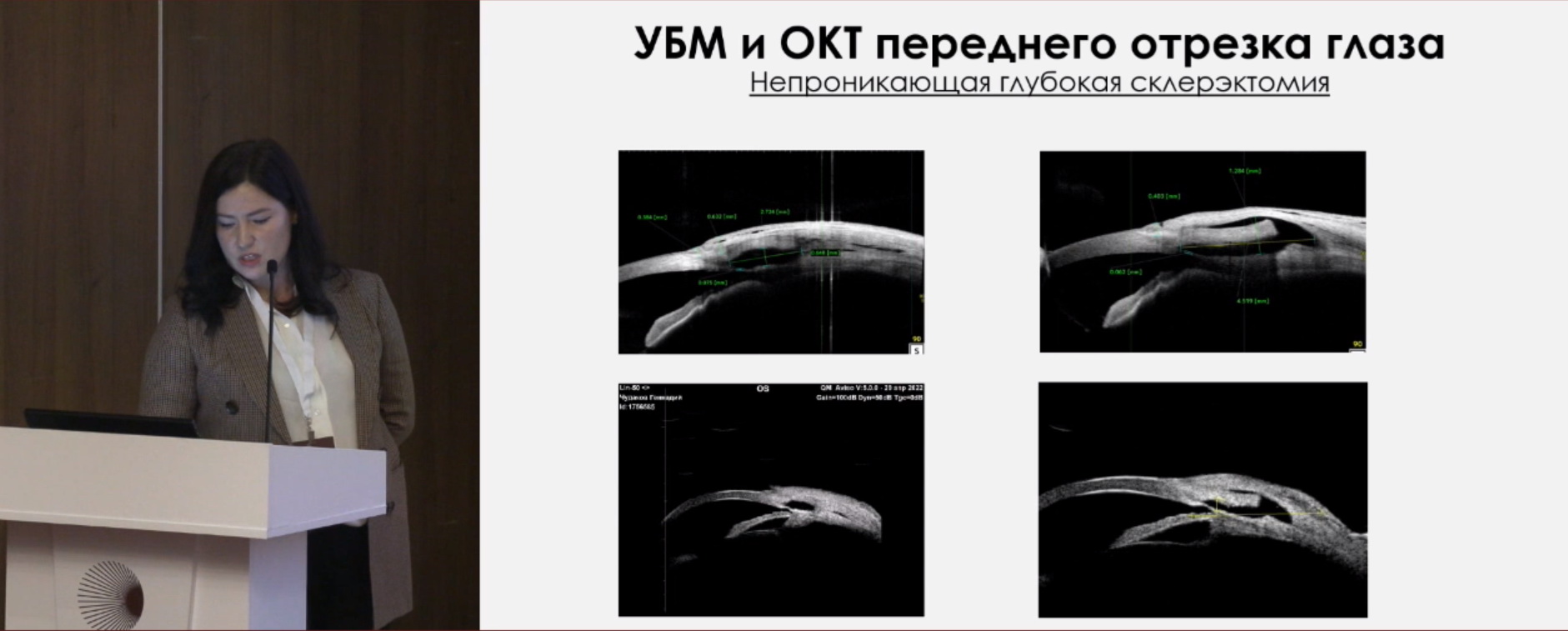
ОКТ переднего отрезка глаза после непроникающей глубокой склерэктомии (НГСЭ): фильтрационная подушка – высота (мм), склеральный лоскут – толщина (мм), интрасклеральная полость – высота (мм), ширина (мм), ТДМ – толщина (мм).
Ультразвуковая биомикроскопия – объективная методика визуализации структур переднего отрезка глаза высокого разрешения (35-100 мГц); возможность выполнения поперечных и аксиальных сканов; качественная и количественная оценка структур переднего отрезка глаза. Контактный метод, проводится при положении пациента лежа. Противопоказания: ранний послеоперационный период, инфекции передней поверхности глаза и век. Преимущества: визуализация структур, расположенных за пигментным листком (задняя камера, цилиарное тело, хрусталик, связочный аппарат хрусталика, цилиарное тело); возможно выполнение при помутнениях роговицы.
На рис. 4 – сравнение ОКТ (верхние снимки) и УМБ после НГСЭ.
В заключение автор отметила, что биомикроскопия и гониоскопия – простые и доступные методы обследования, позволяющие определить состояние зоны антиглаукомной операции на всех этапах наблюдения; преимущества электронной гониоскопии – возможность документации данных обследования для наблюдения в динамике; наиболее удобным для качественной и количественной оценки зоны АГО и мониторинга состояния дренажной системы является ОКТ переднего отрезка глаза; преимуществом УБМ является возможность визуализации структур задней камеры глаза, хрусталика и его связок и состояния цилиарного тела.
А.С. Черкашина (Санкт-Петербург) от группы авторов сделала доклад на тему «Интраоперационный диаметр зрачка при факоэмульсификации и толщина сетчатки в макулярной зоне в после операционном периоде у пациентов с глаукомой». Причинами недостаточного интраоперационного мидриаза являются возраст более 60 лет; ПОУГ, гипотензивные операции в анамнезе; ПЭС; воспалительные заболевания сосудистой облочки в анамнезе с формированием синехий; некомпенсированный сахарный диабет и заболевания сердечно-сосудистой системы; применение некоторых системных препаратов; интраоперационные факторы: хирургическая травма, яркость осветителя микроскопа, реакция зрачка на аккомодацию.
Цель работы заключается в оценке корреляции между диаметром зрачка во время факоэмульсификации и изменением толщины сетчатки в макулярной зоне в послеоперационном периоде в течение 6 месяцев у пациентов с ПОУГ. В исследование включено 94 пациента (108 глаз), которым планировалось оперативное лечение катаракты, разделенные на 3 группы. В 1 и 2 группы вошли 42 пациента с глаукомой, в 3 группу 52 пациента без глаукомы. Пациенты 1 группы использовали инстилляции антибактериальных препаратов (левофлоксацин, дексаметазон), 2 группы – левофлоксацин, дексаметазон, непафенак, 3 группы – левофлоксацин, днксаметазон, непафенак.
Критерии включения: неосложненная катаракта различной степени плотности; компенсированная ПОУГ I-III стадии; гипотензивная терапия препаратами, не оказывающими влияние на диаметр зрачка; отсутствие интраоперационных осложнений.
Критерии исключения: инстилляции аналогов простагландинов, пилокарпина; механическое расширение зрачка или интраоперационное повреждение радужной оболочки; выполнение заднего капсулорексиса; наличие сопутствующей офтальмопатологии, операций, травм органа зрения в анамнезе; наличие сахарного диабета; прием системных препаратов, которые могут вызвать развитие макулярного отека.
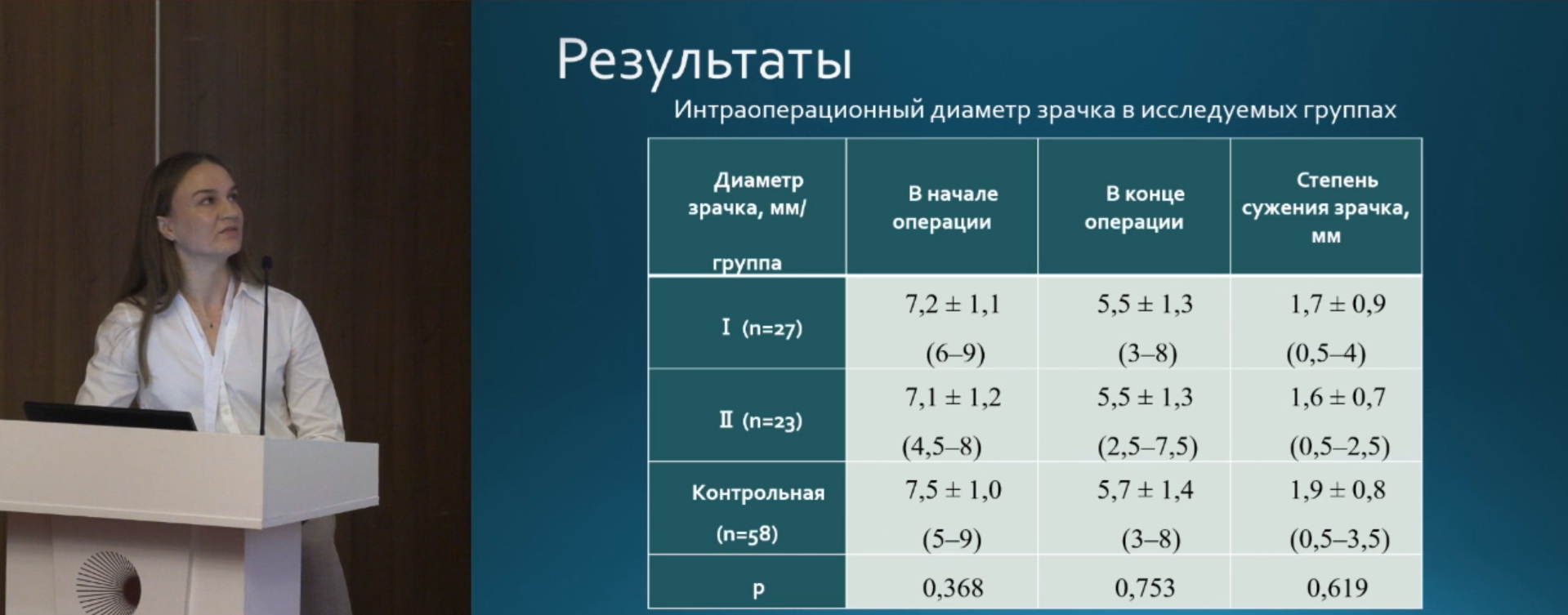
Всем пациентам проведено стандартное офтальмологическое обследование до операции, через 2 недели, 2 месяца, 6 месяцев после операции. Биомикроскопия включала цвет радужной оболочки, состояние пигментной каймы, атрофические изменения стромы, наличие ПЭМ, плотность ядра хрусталика; ОКТ 1-миллиметровой центральной зоны; измерение диаметра зрачка проводилось в начале операции до парацентеза, в конце операции – после вымывания вискоэластика.
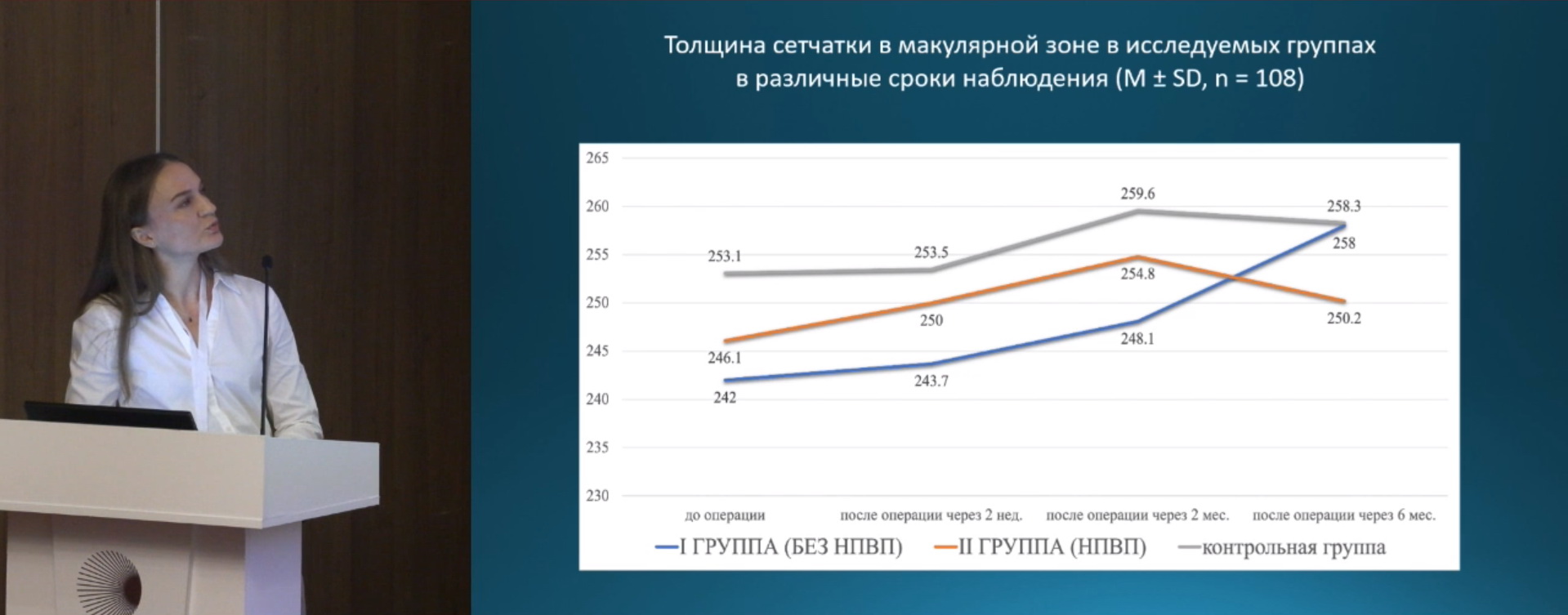
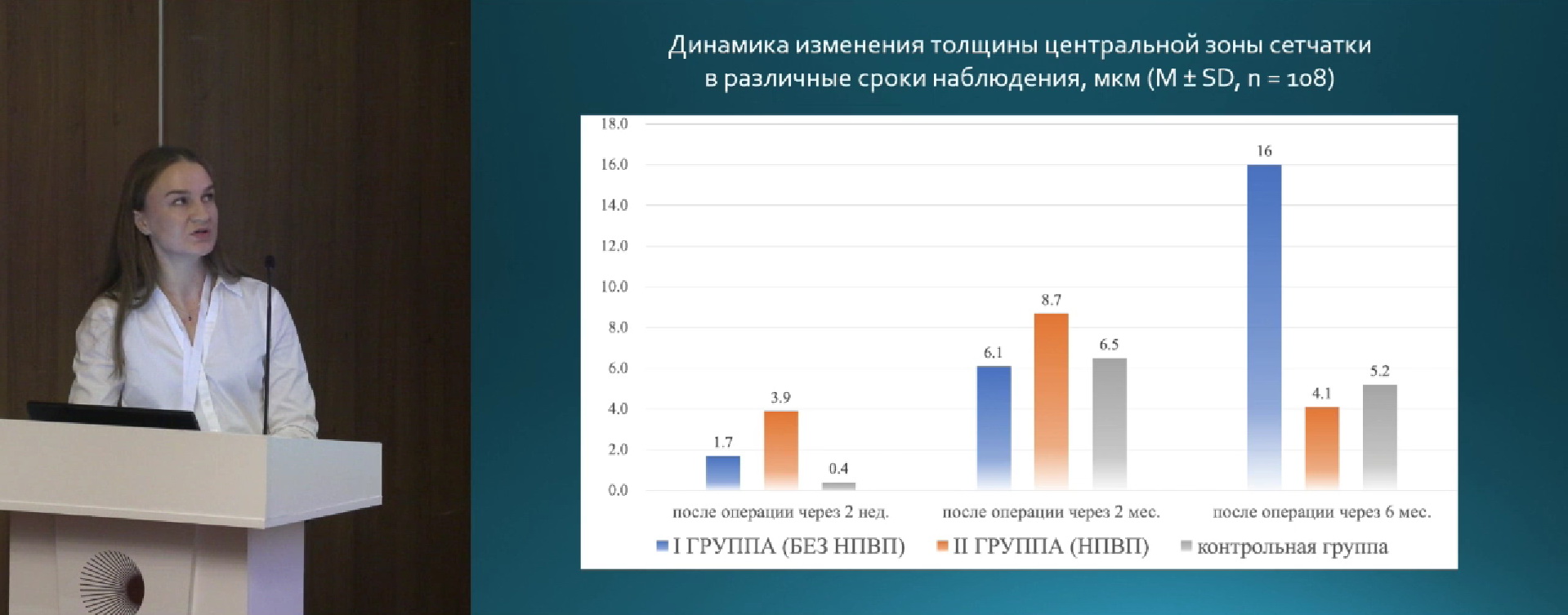
На рис. 1 приведены результаты измерения зрачка: в начале операции, в конце операции, степень сужения зрачка. На рис. 2 представлено изменение толщины центральной зоны сетчатки за весь период наблюдения. Ко второму месяцу происходит увеличение толщины сетчатки у пациентов всех трех групп, однако у пациентов 2 и 3 групп, в которых использовались НПВП наблюдается возврат к исходным значениям.
На рис. 3 представлен прирост центральной толщины сетчатки. У пациентов 1 группы, в которой не применялись НПВП чаще выявлялся субклинический макулярный отек.
Не было получено корреляции между степенью сужения зрачка и изменением толщины центральной зоны сетчатки за все сроки наблюдения; также не выявлено корреляции между степенью сужения зрачка и ультразвуковыми и гидродинамическими параметрами ФЭК в исследуемых группах.