И.Б. Алексеев1, В.В. Страхов2, Н.В. Мельникова3, В.В. Алексеев2
1 Кафедра офтальмологии ГБОУ ДПО РМАПО Минздрава России;
2 Кафедра офтальмологии Ярославского государственного медицинского университета;
3 Филиал № 1 «Офтальмологическая клиника» ГБУЗ ГКБ им. С.П. Боткина ДЗМ
Проблема глаукомы является одной из наиболее актуальных и важных в офтальмологии, имеющей большое медико-социальное значение ввиду высокой распространенности и тяжести исходов заболевания, нередко ведущих к слепоте и инвалидности [6].
Результаты многоцентровых эпидемиологических исследований, проведенных в последнее десятилетие в разных странах, свидетельствуют о значительном росте заболеваемости глаукомой. Так, по данным H. Quigly (1996—2009), число больных глаукомой в мире составляет 66 млн человек, но к 2020 году их количество, возможно, возрастет до 79,6 млн человек. По расчетным данным I. Goldberg (2000), к 2030 году число больных глаукомой может увеличиться в 2 раза, причем 80% этих больных живут в развивающихся странах. В 2011 году приведены уже другие цифры — 105 млн больных глаукомой в мире, слепых на оба глаза — 9,1 млн человек.
В Европе — 160 тыс. слепых от глаукомы. Слепота от глаукомы в Европе варьирует от 6,7% (Дания) до 20% (Швеция). По данным ВОЗ, девять из десяти слепых живут в развивающихся странах [12, 14].
В России в большинстве регионов в последние годы также отмечается рост заболеваемости глаукомой. Так, ее анализ за период 1994—2002 гг., проведенный в 27 субъектах РФ, показал повышение частоты глаукомы в среднем от 3,1 до 4,7 на 1000 населения.
Удельный вес глаукомы среди причин инвалидности, по данным В.В. Нероева (2012 г.), за последние годы возрос в РФ с 14% до 29%. На настоящий момент число больных глаукомой в России составляет 1 млн человек, и этот показатель имеет тенденцию к увеличению.
Считается, что ежегодно заболевает 1 человек из 1000, причем количество больных с возрастом увеличивается и достигает в группе старше 80 лет 14%. Кроме того, роль глаукомы в снижении зрения и развитии необратимой слепоты возросла за последнее десятилетие с 12 до 20% [12, 14].
Снижение внутриглазного давления (ВГД) возможно с помощью медикаментозного лечения, а также проведением различных лазерных процедур и хирургических воздействий. При этом медикаментозное гипотензивное лечение является базовым методом, который может дополнить другие методы гипотензивных воздействий [4, 7, 13]. В настоящее время количество различных медикаментов очень велико, они широко производятся различными фармакологическими компаниями. Практически все они содержат консерванты, наиболее распространенным из которых является бензалкония хлорид [2, 4, 5, 10]. Как катионный детергент он встраивается в клеточную оболочку, взаимодействует с мембранными липопротеидами, повреждает мембраны, блокирует их барьерные функции и вызывает гибель клеток роговицы, нарушая целостность слезной пленки и способствуя развитию синдрома «сухого глаза» (ССГ) [4, 8, 9].
Синдром «сухого глаза» — это полиэтиологическое заболевание, представляющее собой совокупность ксеротических изменений роговицы и конъюнктивы, вызванных систематическим нарушением стабильности прероговичной слезной пленки [2-5, 11].
Сочетание глаукомы и синдрома «сухого глаза» значительно ухудшает качество жизни пациентов и может являться причиной развития нежелательных осложнений со стороны роговицы.
По степени тяжести синдром «сухого глаза» подразделяют на:
- легкий (с микропризнаками ксероза на фоне рефлекторной гиперлакримии);
- средней тяжести (с микропризнаками ксероза, но уже на фоне умеренного снижения слезопродукции и стабильности прероговичной слезной пленки);
- тяжелый и особо тяжелый (с макропризнаками ксероза на фо-не выраженного или критического снижения слезопродукции) [5, 7].
По мнению ряда авторов (В.В. Страхов, В.Н. Алексеев), при развитии глаукомы первоначальным звеном повреждения является фиброзная оболочка глаза, в частности, склера. Глаукомная склеропатия развивается в результате реперфузионной травмы и развития иммунологического воспаления в склере.
Различают переднюю трабекулопатию, срединную трабекулопатию и заднюю трабекулопатию.
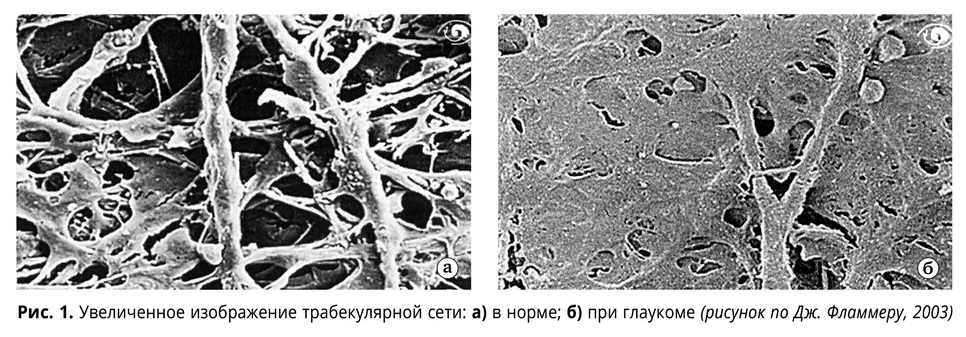
От патологической потери эластичности трабекулярного аппарата, своеобразной передней трабекулопатии, страдает пропускная способность фильтрационной зоны. Если учесть, что только естественное старение приводит к 2-3-кратному утолщению трабекул и отложению в межтрабекулярных пространствах различных продуктов жизнедеятельности хрусталика, зерен пигмента и др. с соответствующим уменьшением площади фильтрации, то что говорить о патологической ригидности, когда уже при преглаукоме и на ранних стадиях глаукомы она двукратно обгоняет инволюционные изменения склеры. Негативные последствия этого процесса для фильтрации камерной влаги хорошо видны, особенно вооруженным глазом.
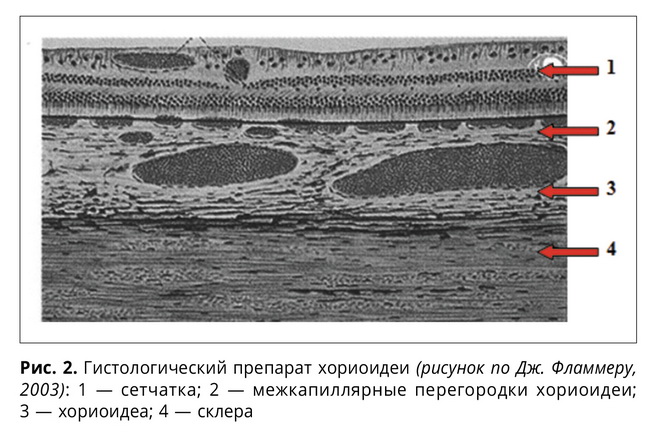
Сеть межкапиллярных коллаге-новых перегородок хороидеи по существу представляет собой такую же трабекулярную ткань, как и трабекулы решетчатой пластины и дренажной системы, но, в отличие от последних, более тонко организованную. Поскольку трабекулярная сеть коллагеновых перегородок хориокапиллярного слоя сосудистой оболочки содержит не пучки нервных волокон, как решетчатая пластина ДЗН, а капиллярные петли хориоидеи, то и отношение она имеет, естественно, к гемодинамике хориокапиллярного слоя сосудистой оболочки. Ясно, что потеря эластичности и склонность к остаточной деформации своеобразной трабекулярной сети на уровне капилляров хориоидеи, наподобие трабекул решетчатой пластины, самым неблагоприятным образом может сказаться на условиях циркуляции крови, вплоть до клинически значимой редукции капиллярного объемного кровотока. Такой механизм гемодинамических нарушений при первичной глаукоме может иметь самостоятельное значение и в определенной степени не зависеть от условий магистрального кровотока в системе задних коротких цилиарных артерий.
Во всяком случае, здесь может скрываться ответ на вопрос: почему объемный внутриглазной кровоток при первичной глаукоме существенно падает уже в самом начале заболевания, когда еще нет значительного подъема ВГД, и никогда не восстанавливается в полном объеме при его нормализации, в том числе хирургическим путем.
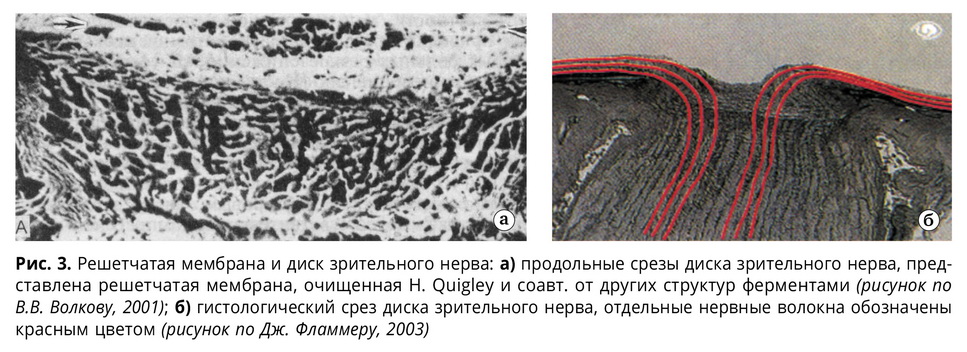
Задняя склеропатия. Одновременно со снижением эластичности трабекул дренажной системы и хориодеи подобным образом развиваются патологические события в области трабекул решетчатой пластины ДЗН. При сравнении гистологических картин решетчатой пластины и препарата хода пучков волокон зрительного нерва через нее в здоровом глазу отмечается очевидное несоответствие между прямолинейным ходом волокон и совершенно криволинейным ходом своеобразных каналов в решетчатой пластине (рис. 3). Более того, количество отверстий в решетчатой пластине на входе не совпадает с количеством их на выходе. При этом считается, что склеральная ткань гораздо плотнее нервной, причем настолько, что деформация склерального канала, например, под действием повышенного ВГД при глаукоме, может повредить и, по-видимому, повреждает, зрительное волокно или, во всяком случае, механически останавливает в нем аксоплазматический ток. Однако такого кажущегося несоответствия может не быть, если представить, что в норме, как раз наоборот, плотность пучка нервных волокон выше, чем плотность окружающей трабекулярной ткани решетчатой пластины склеры.