J.O. Mason с соавт. [51] произвели интравитреальные инъекции бевацизумаба 3 больным с неоваскулярной глаукомой, перенесшим ранее панретинальную лазеркоагуляцию. У всех пациентов регрессировал рубеоз, однако 1 пациенту все же потребовалась хирургическая операция — имплантация дренажа для нормализации ВГД. Авторы предположили, что интравитреальные инъекции бевацизумаба могут быть полезны для лечения больных с неоваскулярной глаукомой для уменьшения риска кровотечения из новообразованных сосудов радужки, а также у тех больных, у которых, несмотря на выполненную ПРК, развился рубеоз радужки. Данный подход, по мнению авторов, позволяет в ряде случаев избежать необходимости проведения дренирующих операций.
S. Grisanti с соавт. [48] проводили инъекции 1,0 мг бевацизумаба в переднюю камеру на 4 глазах у 2 пациентов с вторичной неоваскулярной глаукомой на фоне пролиферативной диабетической ретинопатии и на 2 глазах пациента с ишемической окклюзией центральной вены сетчатки. Уже через день после введения препарата с помощью ФАГ обнаружили уменьшение просачивания красителя из сосудов радужки. В течение 4 недель после лечения отсутствовали какие-либо признаки воспаления и рецидива неоваскуляризации. Аналогичные результаты опубликовал R.L. Avery [49], который отметил регресс неоваскуляризации сетчатки и радужки при пролиферативной диабетической ретинопатии после интравитреального введения бевацизумаба.
Мы также отмечали полный или частичный регресс новообразованных сосудов радужки и угла передней камеры после интравитреального введения 1,25 мг луцентиса (рис. 8).

Рис. 8. Больная Е., 66 лет. Диагноз: СД 2 типа, пролиферативная диабетическая ретинопатия (3 стадия), пороговая неоваскулярная глаукома обоих глаз:
а — УПК левого глаза после и до интравитреального введения луцентиса (открыт, широкий, отчетливо видны новообразованные сосуды, ВГД нормальное); б — УПК левого глаза после интравитреального введения луцентиса (рубеоз радужки регрессировал, новообразованные сосуды УПК подверглись частичному обратному развитию, ВГД нормальное)
В настоящее время механизм снижения ВГД после инъекций бевацизумаба не совсем понятен, особенно на глазах с полным закрытием угла передней камеры с образованием синехий. На глазах с неоваскулярной глаукомой и с блокадой угла передней камеры новообразованной пролиферативной тканью без образования синехий инъекция авастина приводит к регрессу новообразованной ткани радужки и угла передней камеры, снижает воспалительную реакцию в передней камере, улучшая тем самым фильтрацию через пока еще функционирующую трабекулярную ткань. Теоретически этого не должно быть в случаях полного закрытия угла за счет контракции фиброваскулярной мембраны, вызвавшей круговую переднюю синехию. Однако наш клинический опыт свидетельствует о том, что кратковременная нормализация ВГД возможна даже в этом случае. Однако, как только рост сосудов возобновляется, ВГД вновь повышается. S. Yazdani с соавт. [53] постулировали «обратимое анатомическое закрытие» в области угла передней камеры в случаях, когда он закрыт неоваскулярной тканью не полностью и на протяжении недлительного времени. По мнению авторов, регрессия претрабекулярной неоваскулярной мембраны способна частично разблокировать угол передней камеры и возобновить движение жидкости. Дополнительным объяснением авторов является факт присутствия функционирующей трабекулярной сети, гониоскопически невидимой из-за уже закрытого угла передней камеры. Регрессия сосудов в области УПК может в какой-то степени улучшить фильтрацию через эту ткань.
Гипотензивный эффект бевацизумаба при неоваскулярной глаукоме является временным. Признаки рецидива неоваскуляризации, как правило, появляются через 6-8 недель и могут потребовать повторных введений препарата, особенно если ишемический процесс в сетчатке не устранен должным образом [44, 47, 53]. Очевидным является тот факт, что повторные интравитреальные инъекции потенциально представляют риск внутриглазной инфекции и кровотечения, помимо очевидного многократного стресса, вызванного самой хирургической операцией. Таким образом, изолированная инъекция бевацизумаба не может рассматриваться в качестве самостоятельного и полноценного лечения неоваскулярной глаукомы, даже включая глаза с блокадой УПК новообразованной тканью и без синехий. Интравитреальное введение ингибиторов ангиогенеза необходимо комбинировать с панретинальной лазеркоагуляцией для полного устранения ретинальной ишемии и регресса рубеоза угла передней камеры и радужки.
Если у пациента имеется значительное закрытие угла передней камеры или если ВГД после выполненной ПРК и назначения медикаментозной терапии существенно не уменьшается и остается стабильно высоким, необходимо переходить к хирургическим методам лечения глаукомы.
Фистулизирующая хирургия. Стандартные операции (синустрабекулэтомия, глубокая склерэктомия, непроникающая глубокая склерэктомия и их модификации) при лечении неоваскулярной глаукомы, как правило, безуспешны и, кроме того, показаны только при открытом угле передней камеры. Предпринималось множество попыток улучшить их результаты за счет использования антиметаболитов (5-фторурацила, митомицина-C), CO2 лазера, Supramid имплантов [54-58]. J.C. Tsai с соавт. [54] показали, что фистулизирующая (фильтрационная) хирургия с 5-фторурацилом оказалась эффективной лишь в 28% случаев в течение 5 лет. Причем пациенты с сахарным диабетом моложе 50 лет имели худший прогноз. Пациенты же более старшего возраста получали хороший, но краткосрочный эффект, который нивелировался к 3 годам наблюдения. Интраоперационное применение митомицина-C оказалось более эффективным по сравнению с 5-фторурацилом. Однако использование митомицина-С часто приводило к образованию кист теноновой капсулы с последующим повышением ВГД [55]. Известно также, что тканевой активатор плазминогена может способствовать уменьшению образования фибрина и снижает вероятность заращения фистулы [59].
T.E. Eid с соавт. [60] сравнили эффективность фистулизирующей хирургии с Nd:YAG-лазерной циклокоагуляцией у 24 больных с неоваскулярной глаукомой. Непосредственные результаты лечения оказались схожими. Однако через 3 года отсутствие нормализации ВГД в группе диодной циклокоагуляции составило 71,2%, тогда как после фистулизирующих операций неудачи были отмечены лишь в 43,3%. При этом 11 из 24 пациентов в группе лазерной циклокоагуляции и 4 из 24 пациентов после фистулизирующей операции потеряли способность к восприятию света.
Возможно, решению проблемы лечения неоваскулярной глаукомы помогут хирургические вмешательства, при которых оперативный доступ к водянистой влаге осуществляется путем «обхода» структур угла передней камеры с обильной неоваскуляризацией.
В 1985 году Ю.Е. Батманов и соавт. [61] разработали метод фильтрующей склерцикловитрэктомии. Суть операции заключается в создании постоянной фистулы в зоне плоской части ресничного тела, соединяющей стекловидную камеру глаза с субконъюнктивальным пространством. В результате витреальная влага, содержащая вазопролиферативные факторы, не поступает в заднюю и передние камеры глаза, а оттекает в сформированный после витрэктомии полостной «карман» и далее — под конъюнктиву.
Х.П. Тахчиди [62] разработана операция дренирования задней камеры глаза через ресничную борозду с формированием фистулы, в том числе с помощью излучения диодного лазера (рис. 9). Она применима как при первичной закрытоугольной глаукоме [62], так и при вторичной неоваскулярной. По данным Д.И. Иванова и соавт. [63], у 43% больных с неоваскулярной глаукомой в результате такого вмешательства достигнута устойчивая нормализация офтальмотонуса.
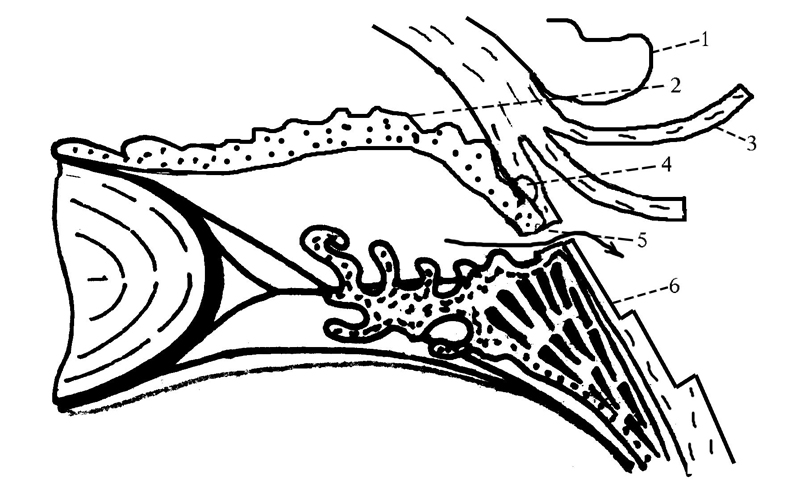
Рис. 9. Дренирование задней камеры глаза через ресничную борозду посредством формирования фистулы с помощью излучения диодного лазера по Х.П. Тахчиди (1992): 1 — отсепарованный лоскут конъюнктивы, откинутый на роговицу; 2 — радужка, блокирующая роговично-склеральную трабекулу; 3 — лоскут, выкроенный из поверхностных слоев склеры; 4 — проекция роговично-склеральной трабекулы и склерального венозного синуса; 5 — транссклеральная фистула, соединяющая ресничную борозду и подлоскутное пространство (стрелками показано направление движения фильтрующей водянистой влаги); 6 — ложе иссеченного глубокого листка склеры
Д.О. Шкворченко и О.В. Каштан [64] модифицировали эту операцию, используя при формировании трансцилиарной фистулы излучение аргонового лазера (мощность — 0,2-0,5 Вт, экспозиция — 0,2 с), и дополнили ее частичной витрэктомией через фистулу в сочетании с периферической криопексией сетчатки. В результате такого вмешательства авторам удалось нормализовать офтальмотонус у 31 из 37 больных, страдающих неоваскулярной глаукомой.
Дренажная хирургия. Невысокая эффективность и большое число осложнений различных модификаций циклодеструкции и фильтрационной хирургии побудила к поиску новых технологий лечения рефрактерной неоваскулярной глаукомы. Одним из таких направлений стало создание различных дренажей для обеспечения направленного оттока водянистой влаги под конъюнктиву.
Еще в 1959 году E. Epstain разработал дренажную трубочку и продемонстрировал ее возможности для снижения ВГД. Однако данное устройство не позволило добиться удовлетворительных результатов в связи с довольно быстрым закрытием наружного конца трубки соединительной тканью. В 1968 году А.С.B. Molteno [65] предложил соединить дренажную трубку с емкостью, напоминающей тарелку, которая имплантировалась под конъюнктиву. Она обеспечивала сохранение фильтрационной подушки, однако не дозировала скорость фильтрации жидкости, что в большинстве случаев приводило к гиперфильтрации жидкости с образованием гигантских фильтрационных подушек и гипотонии.
В целях регулирования оттока водянистой влаги были созданы дренажи с клапанными устройствами. Первым таким устройством стал клапан J. Krupin (1976) [66]. В 1993 году M. Ahmed разработал клапанное устройство, состоящее из трубочки, соединенной с двухмембранным силиконовым клапаном, заключенным в полипропиленовый корпус-резервуар (рис. 10, 11). Истинное ВГД, при котором клапан открывается, составляет 8 мм рт.ст. В настоящее время это один из самых популярных дренажей, применяемых при лечении рефрактерной глаукомы, в том числе и неоваскулярной [67].

Рис. 10. Внешний вид клапана Ахмеда
Ценность этих операций заключается также и в том, что они могут применяться как при открытом, так и при полностью закрытом угле передней камеры (рис. 11б).
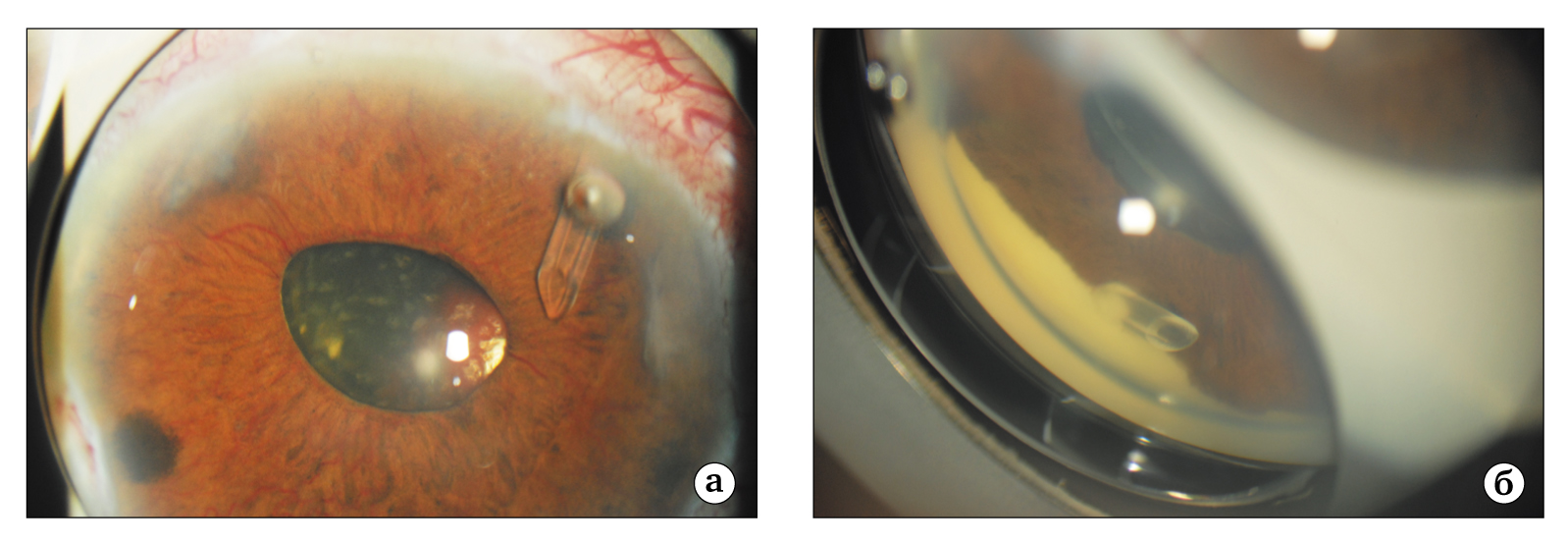
Рис. 11. Больная Ц., 55 лет. Диагноз: СД 2 типа на инсулине, пролиферативная диабетическая ретинопатия обоих глаз, манифестная неоваскулярная правого глаза: а — дренажная трубка клапана Ахмеда в передней камере правого глаза; рубеоз радужки, ВГД = 25 мм рт.ст по Маклакову при полной органической блокаде угла передней камеры корнем радужки; б — гониоскопическая картина закрытого корнем радужки УПК с выведенной дренажной трубкой клапана Ахмеда в переднюю камеру
Эффективность использования различных дренажей варьирует от 22% до 97% при лечении пациентов с неоваскулярной глаукомой [68]. В 1995 P.A. Sidoti с соавт. [69] сообщили, что имплантация дренажа Baerveldt оказалась успешной в 79% случаев медикаментозно некомпенсированной неоваскулярной глаукомы через 12 месяцев после операции и в 56% случаев — через 18 месяцев. Острота зрения 31% пациентов оставалась неизменной или улучшилась, а 31% прооперированных потеряли световосприятие.
J.K. Luttrull и R.L. Avery [70] проводили витрэктомию и имплантацию дренажной трубки через плоскую часть цилиарного тела в стекловидную камеру. Они добились снижения ВГД до 6-21 мм рт.ст. на всех 22 глазах с неоваскулярной глаукомой. Только на одном глазу было потеряно восприятие света. В 2000 году I.U. Scott с соавт. [71] также показали высокую эффективность данного комбинированного метода, однако авторы предупредили, что острота зрения после данной операции может быть невысокой как из-за тяжести основного заболевания, так и возможных операционных и послеоперационных осложнений.
Большинство дренажей изготавливаются из различных полимерных материалов, свойства которых со временем изменяются, что сопровождается ухудшением их дренажной функции [72, 73]. При использовании таких полимерных материалов, как силикон и пропилен, примерно в 20% случаев наблюдается образование рубцовой фиброзной ткани в области наружного и внутреннего отверстия дренажной трубки или вокруг нее, что приводит к его сдавлению или обтурации просвета [74-77]. В 2004 году Санкт-Петербургским филиалом МНТК «Микрохирургия глаза» совместно с производственной компанией «ВИМ» был разработан и апробирован в экспериментальных и клинических условиях оригинальный эксплантодренаж, предназначенный для имплантации в переднюю камеру глаза, изготовленный из лейкосапфира (инертный, биологически совместимый материал высокой прочности, сохраняющий свои свойства неизменными в течение многих десятилетий (патент РФ на полезную модель № 53894, авторы — Х.П. Тахчиди, Л.И. Балашевич, В.В. Науменко, Качурин А.Э.) [78] (рис. 12, 13). Оценка эффективности данного дренажа при лечении неоваскулярной глаукомы продолжается [79].

Рис. 12. Общий вид сапфирового дренажа, разработанного группой сотрудников ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова Росмедтехнологии» (Тахчиди Х.П., Балашевич Л.И., Науменко В.В., Качурин А.Э.)