Флюоресцентная ангиография может быть полезна для раннего выявления субклинических проявлений неоваскуляризации переднего сегмента глаз пациентов и прежде всего радужки [21] . При наличии патологии уже на ранних фазах прохождения красителя выявляется отчетливая гиперфлюоресцирующая сосудистая сеть в области зрачкового края радужки, а на более поздних фазах исследования отмечается постепенное накопление флюоресцеина с выходом за пределы сосудистой сети (рис. 6).
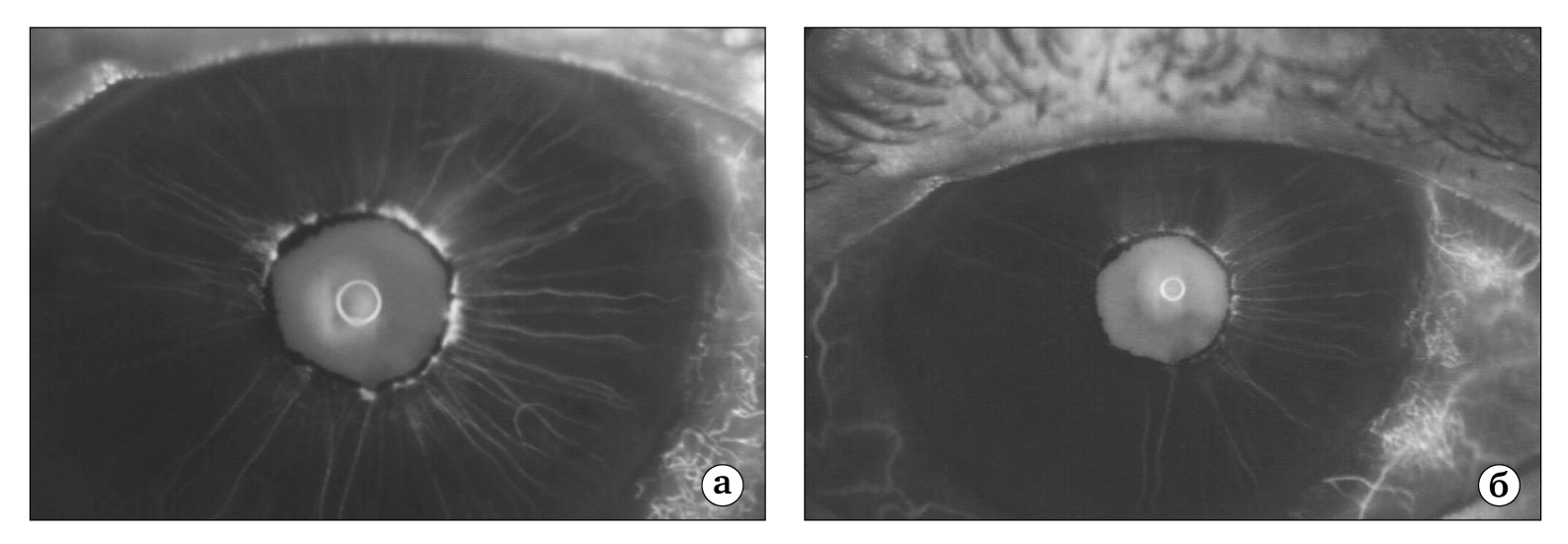
Рис. 6. Флюорограммы сосудов радужки глаза больного с уже выраженным ее рубеозом: а — 19-я секунда исследования: гиперфлюоресценция новообразованной сосудистой сети по зрачковому краю радужки; б — 70-я секунда исследования: накопление красителя и его выход за пределы новообразованных сосудов
Весьма полезным исследованием для ранней диагностики неоваскулярной глаукомы является флюоресцентная ангиография угла передней камеры. В 1994 году Y. Ohnishi с соавт. [22] сообщили, что в 30 из 100 диабетических глаз новообразованные сосуды угла передней камеры были выявлены при гониоскопии, в то время как в результате ФАГ — уже на 56 глазах.
Недавно была показана возможность раннего выявления новообразованных сосудов угла передней камеры с помощью ангиографии с красителем индоцианин-зеленым [23]. Однако этот метод является пока малодоступным для большинства офтальмологов. Кроме того, его диагностическая ценность не получила еще должного подтверждения.
Флюоресцентно-ангиографическое исследование сетчатки, особенно ее периферических отделов, может помочь в выявлении зон ее ишемии, наличие которых увеличивает риск появления неоваскулярной глаукомы.
Полезным диагностическим исследованием может стать и электроретинография. В принципе она позволяет дать оценку состояния периферических отделов сетчатки, труднодоступных для исследования путем офтальмоскопии и флюоресцентной ангиографии. К примеру, такая ситуация возникает при недостаточной прозрачности оптических сред глаза или ригидности узкого зрачка. По мнению ряда исследователей, с помощью электроретинографии можно оценить степень ишемии сетчатки и, следовательно, предсказать вероятность развития у пациента рубеоза. Тем не менее опубликованные на этот счет данные пока достаточно противоречивы [24-26].
Таким образом, на сегодняшний день решающее значение в диагностике глазного рубеоза следует отводить тщательной и систематически проводимой гонио- и биомикроскопии переднего отдела глаза у всех пациентов, страдающих сахарным диабетом.
Лечение больных на различных стадиях развития неоваскулярной глаукомы
Существует два основных направления в терапии глаукомы рассматриваемого вида. Во-первых, это адекватное воздействие на основное заболевание, ответственное за появление рубеоза, а во-вторых — энергичная и целенаправленная симптоматическая терапия. В большинстве случаев она направлена на подавление развивающейся ишемии сетчатки. Выбор алгоритма действий врача определяется четырьмя основными показателями: состоянием угла передней камеры, сетчатки, величиной офтальмотонуса и уровнем зрительных функций пациента. Эти клинические варианты и будут рассмотрены далее.
Tактика ведения пациентов с пороговой стадией развития неоваскулярной глаукомы
При еще нормальном ВГД, но уже измененной картине УПК и радужки (новообразованные сосуды), а также наличии признаков ишемии сетчатки, врач в первую очередь должен принять неотложные меры по борьбе с последствиями этих явлений (алгоритм 2). Это означает, что пациенту в первую очередь следует произвести панретинальную лазерную коагуляцию, причем в полном объеме. Конечно, она возможна только в тех случаях, когда оптические среды глаза достаточно прозрачны, а зрачок удается расширить. Такая тактика поддерживается и другими офтальмологами, так как приносит заметный положительный результат [27-29]. К примеру, после такого вмешательства Y. Ohnishi с соавт. [30] зафиксировали регресс рубеоза у 68% больных и нормализацию ВГД — у 42% из них. В 1993 году M. Striga и M. Ivanisevic [29] сообщили, что панретинальная лазеркоагуляция объемом от 1200 до 1600 коагулятов диаметром 500 мкм приводит к регрессу рубеоза в 70,4% случаев, а коагуляция объемом от 400 до 650 коагулятов — в 37,5%. Наш клинический опыт свидетельствует о необходимости еще более «агрессивного» (большего по объему) вмешательства у данной категории больных. Так, для достижения регресса неоваскуляризации радужки нам приходилось наносить от 3000 до 4500 коагулятов (рис. 7). Известны также данные о том, что факт выполнения полного объема ПРК в значительной степени увеличивает эффективность последующих гипотензивных операций фильтрующего типа [30]. У больных СД, которым ПРК выполняли перед экстракцией катаракты, послеоперационный рубеоз радужки был также менее вероятен [14].
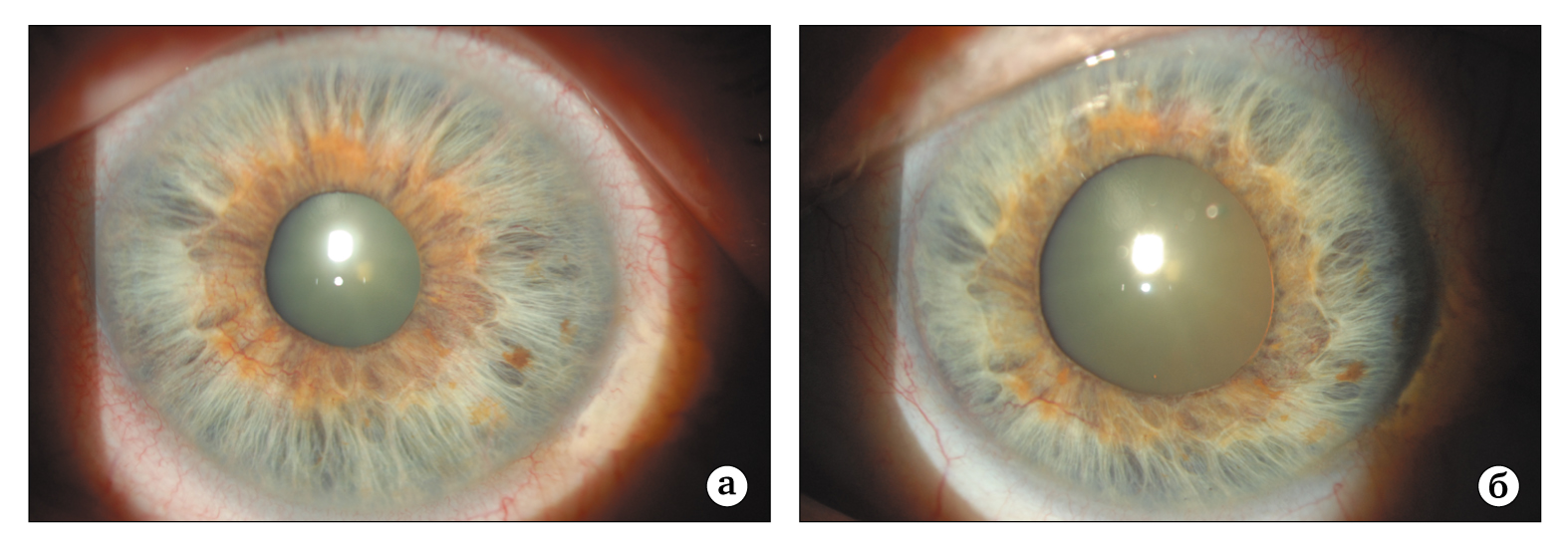
Рис. 7. Больной С., 56 лет. Диагноз: СД 2 типа, непролиферативная фоновая ретинопатия (1 стадия), манифестная неоваскулярная глаукома обоих глаз: а — внешний вид радужки левого глаза до лечения (выраженный рубеоз); б — через 2 месяца после выполнения полного объема ПРК. Значительно уменьшился ее рубеоз, однако зрачок расширился за счет продолжающейся контракции неоваскулярной ткани в углу передней камеры
При проведении сеансов лазерной коагуляции следует обращать особое внимание на тщательное облучение периферических отделов сетчатки. Полный объем такого лечения у данной категории больных необходимо выполнить в сроки, не превышающие 1,5-2 месяца, с последующим постоянным мониторингом состояния радужки, УПК, глазного дна и внутриглазного давления. Мы рекомендуем проводить контрольные осмотры пациентов после лазерного лечения с интервалами, не превышающими 2-3 месяца.
При отсутствии регресса рубеоза на фоне все еще нормального внутриглазного давления необходимо провести интравитреальное введение ингибиторов ангиогенеза (см. далее) и продолжить наблюдение за состоянием пациента.
При сочетании внутриглазного воспаления и ишемической болезни сетчатки в схему лечения больного необходимо ввести местное использование кортикостероидов и других противовоспалительных препаратов [31].
Несмотря на очевидные достоинства транспупиллярной панретинальной коагуляции, тем не менее она применима далеко не у всех пациентов. Препятствием для ее полноценного выполнения служат причины, о которых речь уже шла выше. Именно для таких случаев были предложены транссклеральные методы воздействия на патологическую сетчатку различных физических факторов — тепла, холода и излучения диодного лазера с λ=810 nm. Первый вариант был апробирован и положительно оценен еще в 1960 году, но дальнейшего развития все же не получил [32].
До появления современных лазерных коагуляторов офтальмологического назначения твердые позиции в лечении диабетической ретинопатии длительное время занимала криотерапия [33-35]. Некоторые авторы и сейчас полагают, что она по эффективности сравнима с лазерной коагуляцией сетчатки [33]. Однако уже накопленные новые данные не подтверждают этого мнения.
Что же касается транссклеральной диодной лазерной коагуляции сетчатки, то она была внедрена в клиническую практику в 1989 году. Именно тогда J. McHugh с соавт. [36] описали положительные результаты лечения четырех пациентов с развитым рубеозом. В 1997 году C. Flaxel с соавт. [37] сообщили о результатах лечения 15 глаз c неоваскулярной глаукомой посредством диодной ретинопексии. При этом девять глаз они одновременно подвергли еще и трассклеральной циклокоагуляции тем же лазером. В итоге регресс рубеоза был достигнут в 100% случаев, а на 6 глазах (из 9) нормализовалось ВГД, на 3 глазах развилась гипотония, к счастью, не приведшая к их субатрофии.
В тех случаях, когда полноценная транспупиллярная панретинальная лазеркоагуляци не может быть произведена из-за снижения прозрачности оптических сред глаза, методом лечебного выбора может быть закрытая витрэктомия или экстракция мутного хрусталика с одномоментной или отсроченной на несколько дней эндо- или транспупиллярной лазерной ПРК. Необходимо иметь в виду, что такого рода вмешательства на фоне имеющегося рубеоза могут протекать со значительным количеством осложнений как интраоперационных, так и послеоперационных: появление кровоизлияний и воспаления, усиление рубеоза, резкий подъем внутриглазного давления. В настоящее время врачи располагают реальной возможностью значительно уменьшить риск подобных осложнений благодаря интравитреальному введению ингибиторов ангиогенеза, которые рекомендуется вводить пациентам за 2 недели до выполнения упомянутых выше внутриглазных вмешательств.
Таким образом, имеющиеся на сегодняшний день знания по проблеме лечения больных с диабетической ретинопатией, осложненной рубеозом на фоне еще нормального внутриглазного давления, позволяют предложить определенный план действий врача, представленный выше алгоритмом 2.
Тактика ведения пациентов с манифестной неоваскулярной глаукомой
При наличии у пациентов с СД рубеоза радужки и УПК, сопровождающихся повышенным внутриглазным давлением, тактика проводимого лечения зависит от состояния зрительных функций пациента. В ряде стран оно классифицируется по признаку наличия или отсутствия так называемого «полезного зрения». В первом случае острота зрения выше 0,05, а центральное поле зрения шире 5 градусов [38].
Если «полезное зрение» сохранено, то пациенту должна быть незамедлительно назначена медикаментозная терапия, направленная на быстрое снижение ВГД, и, при возможности, выполнена панретинальная лазеркоагуляция в том виде, как она была описана выше (алгоритм 3).
Медикаментозная терапия неоваскулярной глаукомы может включать различные препараты, снижающие ВГД. При открытом угле передней камеры без признаков воспалительного процесса может быть назначена монотерапия с помощью β-адреноблокаторов, ингибиторов карбоангидразы. При отсутствии достаточного эффекта необходим переход к комбинированному использованию упомянутых средств. Аналоги простагландина не следует использовать при наличии гониосинехий, так как доступ влаги к увеосклеральным путям может быть нарушен, и эффективность препарата в связи с этим может быть низкой. Кроме того, их применение нежелательно при наличии признаков воспаления, которое может усилиться в ответ на увеличение простагландинов во влаге передней камеры. У таких пациентов целесообразно назначение кортикостероидов, нестероидных противовоспалительных средств и мидриатиков, даже при закрытом УПК. Пилокарпин и другие антихолинергические препараты противопоказаны, так как они могут усилить воспаление, вызвать миоз и образование синехий, а также снижать увеосклеральный отток. Следует также иметь в виду, что тимолол, являясь неселективным β-блокатором, должен использоваться при сахарном диабете с осторожностью, т.к. может маскировать симпатозависимые симптомы — предвестники гипогликемии. β-блокаторы также предрасполагают к развитию гиперкалиемии, подавляя синтез ренина и нарушая захват калия экстраренальными тканями, и могут усиливать гипертриглициридемию. Кроме того, необходимо помнить, что в большинстве случаев изолированная медикаментозная терапия малоэффективна.
После назначения симптоматической медикаментозной терапии незамедлительно должна быть выполнена панретинальная лазеркоагуляция, особенности которой были описаны в предыдущем разделе данной статьи.
Если у пациента после проведения ПРК сохраняется или тем более прогрессирует рубеоз радужки и угла передней камеры, необходимо назначение еще одного патогенетического лечения, направленного на подавление ишемии сетчатки, возможность которого появилась только в последние 2-3 года. Таким пациентам показано интравитреальное введение ингибиторов ангиогенеза.
Ингибиторы ангиогенеза. В последние годы при лечении различных неоваскулярных заболеваний органа зрения начали использовать ингибиторы ангиогенеза (ранибизумаб, бевацизумаб).
Ранибизумаб («Lucentis», Genentech, США) представляет собой антиген-связывающий фрагмент антитела к VEGF, полученный методом генной инженерии (рекомбинантный препарат). Он не селективен, активен в отношении всех изоформ VEGF. Препарат официально разрешен к применению, в том числе и в России, только для интравитреального использования при лечении пациентов с неоваскулярной влажной возрастной макулодистрофией, отеком макулы на фоне диабетической ретинопатии и окклюзии ретинальных вен. Наибольшее распространение по причине более низкой стоимости инъекции получил препарат Bevacizumab («Avastin», Genentech, США), представляющий собой полноразмерное антитело, активное в отношении всех изоформ VEGF-A (неселективный ингибитор VEGF). Этот препарат одобрен в США FDA (Food and Drug Administration) для лечения колоректального рака [39]. Американскими и европейскими офтальмологами этот препарат успешно используется off-label (т.е. не по прямому назначению). Описаны результаты интравитреального использования препарата для лечения рефрактерной диабетической ретинопатии [40], кистозного посттромботического макулярного отека [41], хориоидальной неоваскуляризации на фоне возрастной макулярной дегенерации [42-43], а также при неоваскулярной глаукоме [44-45]. Была проведена серия исследований, целью которых была оценка целесообразности интравитреального использования бевацизумаба в качестве дополнительного метода лечения неоваскулярной глаукомы [40, 45-51].
Y. Oshima с соат. [40] описали 7 случаев неоваскуляризации радужки, возникшей на фоне пролиферативной диабетической ретинопатии. После интравитреальной инъекции бевацизумаба рубеоз регрессировал у всех пациентов уже через 1 неделю, на 2 глазах стабилизация процесса была достигнута через 2 месяца после выполнения повторных инъекций. На 6 глазах ВГД сохранилось нормальным, без признаков воспаления и других осложнений.
M.E. Greith с соавт. [52] и M.Y. Kahook с соавт. [44] отметили снижение ВГД, регресс неоваскуляризации радужки и УПК, а также заметное уменьшение внутриглазного воспаления у пациентов с неоваскулярной глаукомой даже с закрытым углом, но без передних синехий.
M.E. Iliev с соавт. [47] на глазах с неоваскуляризацией и тотально закрытым из-за синехий углом передней камеры не смог добиться нормализации ВГД после интравитреального введения бевацизумаба. Однако последующее хирургическое лечение оказалось успешным и протекало без геморрагических осложнений.
R.C. Tripathi с соавт. [46] показали, что пациенты с неоваскулярной глаукомой имеют значительно повышенный уровень VEGF в водянистой влаге. Они высказали предположение, что в производстве VEGF участвует не только сетчатка, но и ресничный эпителий.
F.H. Davidorf с соавт. [45] описал случай меланомы хориоидеи на фоне диабетической ретинопатии. Пациенту была выполнена транспупиллярная термотерапия по поводу опухоли и ПРК в связи с пролиферативной ретинопатией. Однако впоследствии развилась неоваскулярная глаукома. Пациенту провели интравитреальное введение 1,25 мг бевацизумаба, которое вызвало регресс рубеоза. Впоследствии была выполнена синусотрабекулэктомия. В исходе внутриглазное давление нормализовалось без какого-либо дополнительного лечения.