Б.Э. Малюгин
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»
Тема, которую мы обсуждаем, является одной из наиболее острых. Речь идет об использовании фемтолазерных систем в хирургии катаракты.
Первый клинический опыт таких операций был получен в 2008 году нашими европейскими коллегами, позднее фемтолазер в хирургии катаракты стали использовать североамериканские, а затем и азиатские офтальмологи. На сегодняшний день перед нами дилемма, и она заключается в том, вытеснит ли фемтолазерная хирургия катаракты ультразвуковую факоэмульсификацию и станет ли она новым общепризнанным стандартом хирургического лечения данной патологии.
Для того чтобы прийти к заключению по вопросу, вынесенному в заголовок доклада, необходимо оценить функциональные возможности и конструктивные особенности различных фемтолазерных систем, имеющихся в нашем распоряжении, оценить их потенциальные и реальные преимущества, проанализировать результаты, достигнутые к настоящему моменту. Я также планирую поделиться с вами опытом работы на фемтолазерных установках в системе клиник МНТК «Микрохирургия глаза». Ну и, конечно, упомяну медико-экономические аспекты данной технологии и ее дальнейшие перспективы.
Функциональные возможности фемтолазерных систем в катарактальной хирургии ограничиваются на сегодняшний день тремя основными этапами операции: выполнение разрезов, переднего капсулорексиса и фрагментация ядра. Помимо этого, в качестве опции, производители предлагают релаксирующие разрезы или лимбальную кератотомию.
В распоряжении хирургов на сегодня имеются пять установок различных фирм-производителей, лишь 3 из них зарегистрированы в России. Однако в силу интересных технических решений, все они достойны упоминания. Итак, мы рассматриваем установки LenSx (Alcon), Victus (Bausch+Lomb), Catalys (AMO), LensAR (LensAR) и Galilei (Ziеmer).
По спектру применения данные системы подразделяются на специализированные и комбинированные. Первые предназначены только для хирургии катаракты (LenSx, Catalys, LensAR), в то время как вторые (Victus, Galilei) позволяют хирургу выполнять также рефракционные вмешательства на роговице, кератопластику и формировать тоннели для имплантации внутрироговичных сегментов. С нашей точки зрения, большинство производителей рано или поздно придет к конструкции лазерного комбайна, по крайней мере такая логика, очевидно, прослеживается.
Помимо этого, фемтолазерные системы отличаются по технологиям визуализации структур переднего отрезка глаза, вариантам интерфейса «лазер-пациент» или так называемым системам «докинга». Есть среди них определенные различия в паттернах абляции ядра хрусталика и технологии выполнения разрезов роговицы.
Несколько слов о технологиях визуализации. Для того чтобы прицельно сфокусировать лазерный луч в нужной точке, важно прежде всего визуализировать структуры переднего отрезка глаза и определить их топографические ориентиры. Оптическая когерентная томография (ОКТ) — наиболее распространенная среди технологий визуализации. На рис. 1 представлено изображение переднего отрезка глаза на дисплее лазера. Хорошо видны роговица, радужка и хрусталик, намечены контуры лазерной фрагментации хрусталика. Передняя капсула в поперечном сечении имеет вид волнистой линии вследствие того, что некоторые ее точки расположены выше или ниже изолинии, сама же сканограмма развернута по плоскости. Это определяет особенности паттерна лазерного воздействия, имеющего не линейный, а скорее — лентовидный вид.
Что касается ОКТ, то и здесь есть определенные нюансы. Так, например, некоторые системы (LenSx) осуществляют сканирование переднего отрезка глаза только в самом начале операции, другие (Catalys) — используют постоянный контроль анатомических параметров в режиме реального времени. В последнем варианте лазер способен подстраиваться под вариабельные ситуации, возникающие в ходе операции.
Существенным этапом операции является процесс стыковки рабочей части лазера с глазом пациента. Она может быть «жесткой», когда глаз больного контактирует с апланирующей линзой (LenSx), либо применяется так называемый «жидкий» интерфейс, когда расстояние между линзой и роговицей пациента заполнено солевым раствором (Catalys). Некоторые производители используют их сочетания на различных этапах операции (Victus). Например, при проведении капсулорексиса и фрагментации ядра между роговицей и головкой лазера имеется слой жидкости, который затем удаляется при переходе на этап формирования роговичных разрезов.
В чем особенности этих двух подходов, каковы их преимущества и недостатки? Первоначально производители стали использовать плоские апланационные линзы подобно тем, которые применяются в фемтолазерных системах, предназначенных для рефракционной хирургии. Уплощение роговицы дает возможность получить более ровный и точный ее срез. Однако апланация приводит к образованию складок роговицы на периферии и в центре. Каждая такая складка вызывает эффект микролинзирования и дефокусирует лазерный луч. Следствием этого является неполное просечение ткани, формируемое капсулотомическое отверстие имеет края с перфорациями по типу «почтовой марки». Это, в свою очередь, понижает резистентность капсулорексиса к механическому воздействию и может приводить к его радиальным разрывам в ходе операции со всеми вытекающими последствиями. В силу этого, на настоящий момент, большинство производителей от плоских интерфейсов отказались в пользу вогнутых. Однако и они не позволяют полностью избавиться от данной проблемы.
На рис. 2 представлен пример ОКТ, демонстрирующий образование складок роговицы, которые в основном имеют циркулярный характер и располагаются на ее средней и крайней периферии.
«Жидкий» интерфейс позволяет избежать вышеозначенной проблемы. Кроме того, при его использовании в меньшей степени повышается внутриглазное давление в процессе вакуумной фиксации глазного яблока. Это дает возможность некоторым исследователям (B. Dick, 2013) применять данный лазер, в частности, при проведении заднего кругового капсулорексиса.
Для фрагментации хрусталика, можно еще назвать этот этап «лазерным пре-чопом», как правило, используют радиальные и циркулярные паттерны, а чаще всего — их сочетания. При этом достигается снижение затраченного УЗ на 30-50%. Также описан кубический паттерн фрагментации хрусталика (Catalys), который позволяет некоторым хирургам говорить о том, что в 96% случаев им не понадобилось использовать ультразвуковую энергию на этапе эвакуации содержимого капсульной сумки.
Давайте вернемся к вопросу о том, является ли фемтолазерная экстракция катаракты более эффективной и более безопасной? Очевидно, стремление к новым технологиям основано на ожиданиях, что с их помощью удастся не только повысить эффективность работы хирурга, но, что самое главное, обеспечить лучшую безопасность для пациента.
В головной организации МНТК «Микрохирургия глаза» мы имели возможность сравнить работу двух систем: Victus (Bausch+Lomb) и LenSx (Alcon). В общей сложности к настоящему моменту мы выполнили 137 операций. Следует сказать, что фемтолазерные установки сегодня работают в пяти клиниках системы МНТК. Однако в ходе этого доклада я поделюсь с вами наблюдениями, полученными в головной организации.
Перед клиникой, решившей использовать фемтолазерную экстракцию катаракты (ФЛЭК), в первую очередь встают организационные вопросы: куда поместить лазер, как рационально наладить работу персонала? Многое зависит от того, как инсталлирован лазер. Здесь есть два варианта. Первый — лазер находится непосредственно в операционной. Некоторые наши зарубежные коллеги предпочитают именно этот вариант. Он более предпочтителен для относительно небольших частных клиник, когда хирург может выполнять оба этапа операции, не переходя из одной операционной в другую и не снимая пациента с операционного стола. Второй вариант — это выполнение лазерного и хирургического этапов в разных помещениях, что, по-видимому, более оправдано для ситуаций, когда мы имеем дело с крупными специализированными клиниками и большим потоком пациентов.
Но в том и в другом случае нам требуется дополнительный персонал. Как минимум — это оператор, который будет следить за настройкой и подготовкой прибора и вводить данные. При раздельной инсталляции — необходим второй хирург, выполняющий лазерный этап вмешательства.
Наш опыт установки лазера в отдельных помещениях и выполнении обоих этапов операции одним хирургом показал, что такое распределение является нерациональным. Данный алгоритм работы операционной не только не ускоряет, напротив — существенно замедляет течение потока пациентов. Лазерный этап занимает относительно немного времени, как правило, порядка восьми минут. Однако при этом продолжительна пауза между операциями. И это достаточно существенный фактор, как видно из представленных на рис. 3 цифр. Следует подчеркнуть, что данный фактор не зависел от типа лазерной установки (Victus, LenSx).
Теперь обратимся к особенностям техники лазерной экстракции. И здесь мы должны осознать, что степень автоматизации ФЛЭК вовсе не тождественна ее простоте. Как и ряд других хирургических технологий, она требует определенного периода обучения. Последнее является многосторонним и предполагает не только техническое освоение прибора, но и адаптацию приемов хирурга и его навыков к особенностям методики операции.
Докинг — новый этап, непривычный для катарактального хирурга, однако хорошо знакомый коллегам, выполняющим лазерные рефракционные вмешательства. К нашему удивлению, пациенты, большинство из которых были преклонного возраста, хорошо переносили этот этап. Он, как правило, не вызывал существенного дискомфорта и субъективных отрицательных ощущений и, за исключением двух случаев, был успешен. Оба эти случая были связаны с особенностями анатомического строения глаза или лицевого скелета, которые не позволили произвести стыковку головки лазера с глазом, обеспечивающую надежную вакуумную фиксацию последнего.
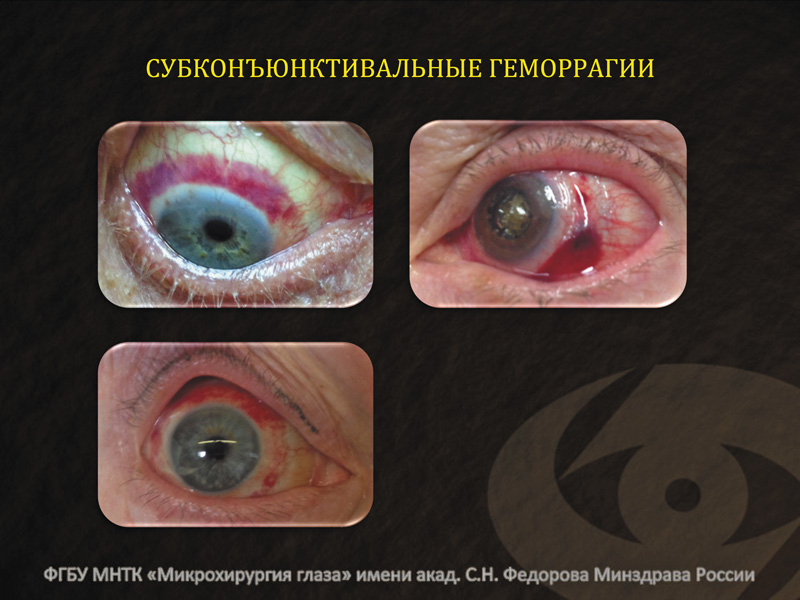
С другой стороны, использование вакуумной фиксации глазного яблока вызывало характерные субконъюнктивальные геморрагии примерно у 70-80% пациентов. На рис. 4 видна довольно характерная картина геморрагии в виде полоски, располагающейся концентрично лимбу. Вакуумная фиксация, на фоне повышенной ломкости и проницаемости капилляров у пациентов преклонного возраста, служит причиной развития данного осложнения.