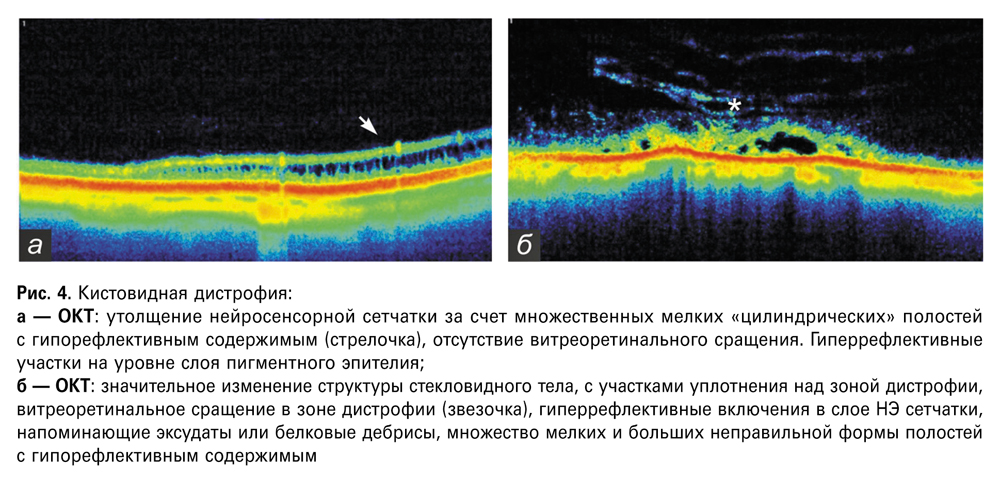
Кистовидная дистрофия выявлена у 5 пациентов (10 глаз), во всех случаях она определялась в области крайней периферии, параллельно зубчатой линии. Преимущественно локализовалась в верхненаружном сегменте (50%), реже — в нижненаружном (20%), в верхневнутреннем (20%), в нижневнутреннем (10%). При офтальмоскопии дистрофия определялась как микрокистозное поражение розоватого цвета на сером фоне рыхлой (пастозной) сетчатки. По данным ОКТ выявлены две морфологические формы кистовидной дистрофии: 1-я форма (7 глаз) — без тракции стекловидного тела (рис. 4а); 2-я форма (3 глаза) — с тракцией витрума (рис. 4б). 1-я форма характеризовалась «регулярным» расположением микрокист (имеющих вертикально вытянутую форму) в области дефекта, преимущественно локализованных в определенном слое нейроэпителия сетчатки и с сохранением структурирования части сетчатки, при этом стекловидное тело над дистрофией — без видимых изменений. 2-я форма определялась наличием микрокист разной формы и величины без определенной локализации в слоях нероэпителия на фоне значительных изменений в слое нейроэпителия и пигментного слоя сетчатки, витреальных тракций деструктивно измененного стекловидного тела.
Протяженность дистрофии составляла от 3,4 до 6 мм и более (скан длиной более 6 мм не выполнялся). Толщина сетчатки по краю дефекта — от 114 до 157 мкм, в области кист — от 285 мкм до 351 мкм, высота витреоретинального сращения — от 314 до 351 мкм.
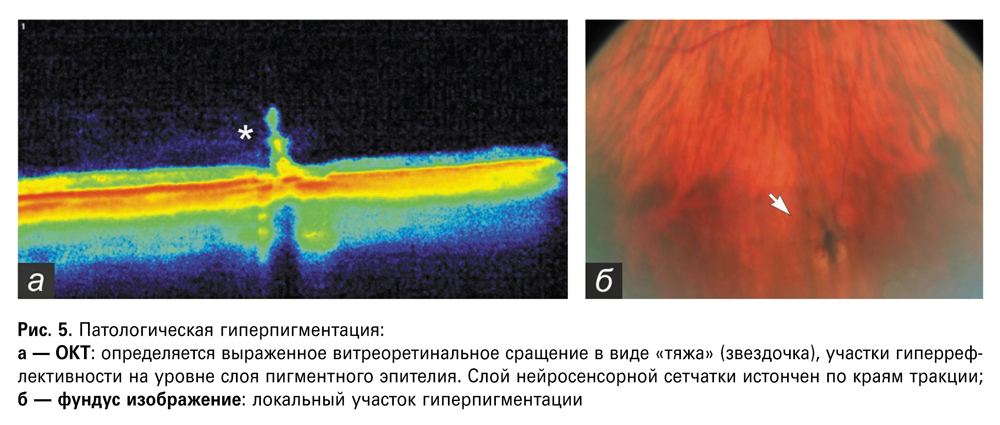
Патологическая гиперпигментация выявлена у 24 пациентов (28 глаз), определялась преимущественно в области экватора (64,3%) и реже — на крайней периферии. Локализовались в верхненаружном сегменте (46,4%), реже — в нижненаружном (32,1%), в верхневнутреннем (14,3%), в нижне-внутреннем (7,2%). Двусторонняя локализация выявлена у 37,5% пациентов. Офтальмоскопически дистрофия выглядела как скопление множественных пигментных глыбок черного цвета, без определенной формы, на поверхности которых иногда определялись белесоватые, штрихообразные включения. При ОКТ сканировании определялись выраженные витреоретинальные сращения в виде «тяжа» (звездочка), участки гиперрефлективности на уровне слоя пигментного эпителия, истончение слоя нейросенсорной сетчатки по краям тракции.
У большинства глаз (57,1%) с патологической гиперпигментацией при ОКТ сканировании выявлена тракция стекловидного тела в зоне пигментного скопления (рис. 5). Протяженность дистрофии по данным ОКТ составляла от 779 мкм до 1,56 мм. Толщина сетчатки по краю дефекта — от 138 до 367 мкм, в области центра — от 187 до 397 мкм, высота витреоретинального сращения — от 212 до 672 мкм.
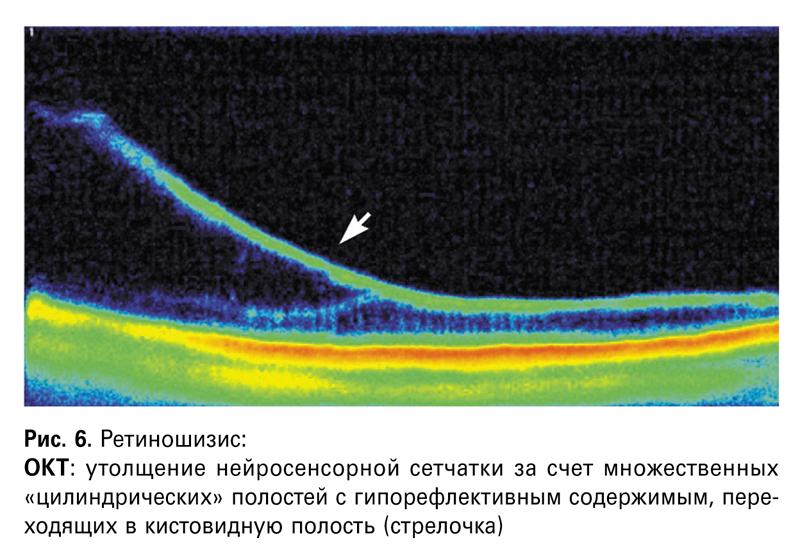
Ретиношизис был выявлен у 10 пациентов (18 глаз). Преимущественная локализизация наблюдалась в нижненаружном сегменте (72,2%), реже — в верхненаружном (16,7%), в нижневнутреннем (11,1%). Двустороннее поражение наблюдалось у 8 пациентов (80%).
При офтальмоскопии глазного дна на периферии определялась гладкая, полупрозрачная зона элевации сетчатки с четкими границами. На поверхности ретиношизиса у 12 глаз выявлены отложения белесоватых точек по типу «инееподобной» дистрофии, у 2 глаз — облитерированные сосуды по типу симптома «серебряной проволоки», у 3 глаз определялись разрывы в наружном слое дистрофии. Анализ полученных ОКТ-изображений показал множество кистовидных образований, укрупняющихся к центру дефекта, а также расслоение сетчатки на два слоя: наружного и внутреннего (рис. 6). Протяженность выявлена от 5,6 мм и выше. Высота проксимального края ретиношизиса составляла от 148 до 259 мкм, дистального — от 615 до 1640 мкм, высота витреоретинального сращения от 464 до 727 мкм.
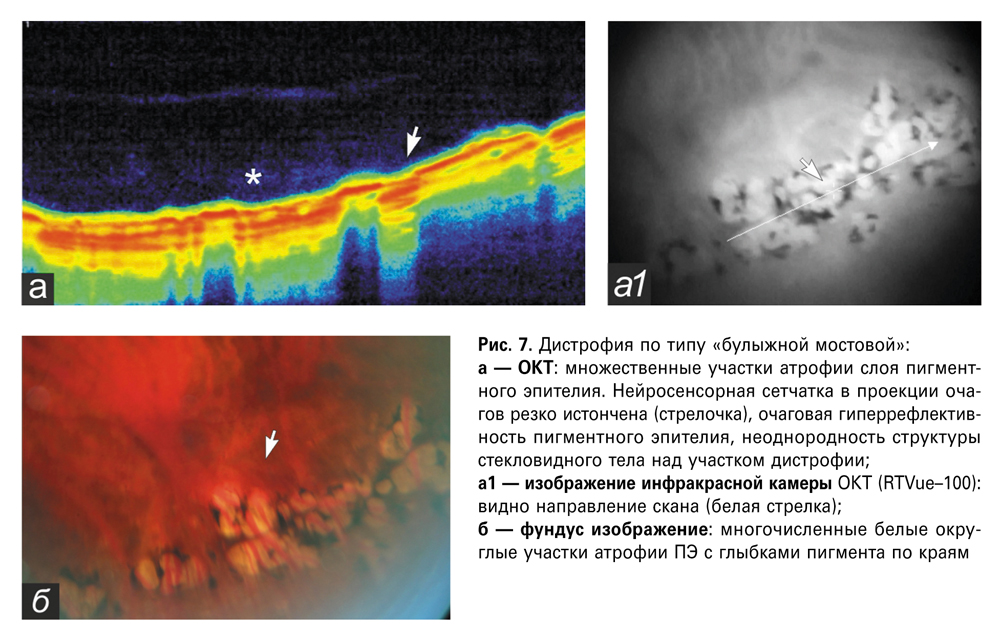
Хориоретинальная атрофия по типу «булыжной мостовой» была диагностирована у 9 пациентов (14 глаз). Локализовалась в основном за экватором, в области крайней периферии в нижненаружном (35,7%), в верхненаружном (28,6%), в верхневнутреннем (14,3%), в нижневнутреннем (21,4%) сегменте. Двухстороннее поражение сетчатки встречалось у 64,7%. Офтальмоскопически «булыжная мостовая» определялась множественными атрофическими белыми фокусами округлой, иногда вытянутой формы, с различной плотностью прилегающих друг к другу, окруженными крошками или каймой пигмента.
На ОКТ определялись очаговая гиперрефлективность пигментного эпителия с истончением нейросенсорной сетчатки, а также неоднородность структуры стекловидного тела над участком дистрофии (рис. 7). Протяженность дистрофии по данным ОКТ составляла от 3,6 мм и выше. Толщина сетчатки по краю дефекта — от 100 до 138 мкм, в области дна — от 0 до 57 мкм, высота витреоретинального сращения — от 301 до 366 мкм.
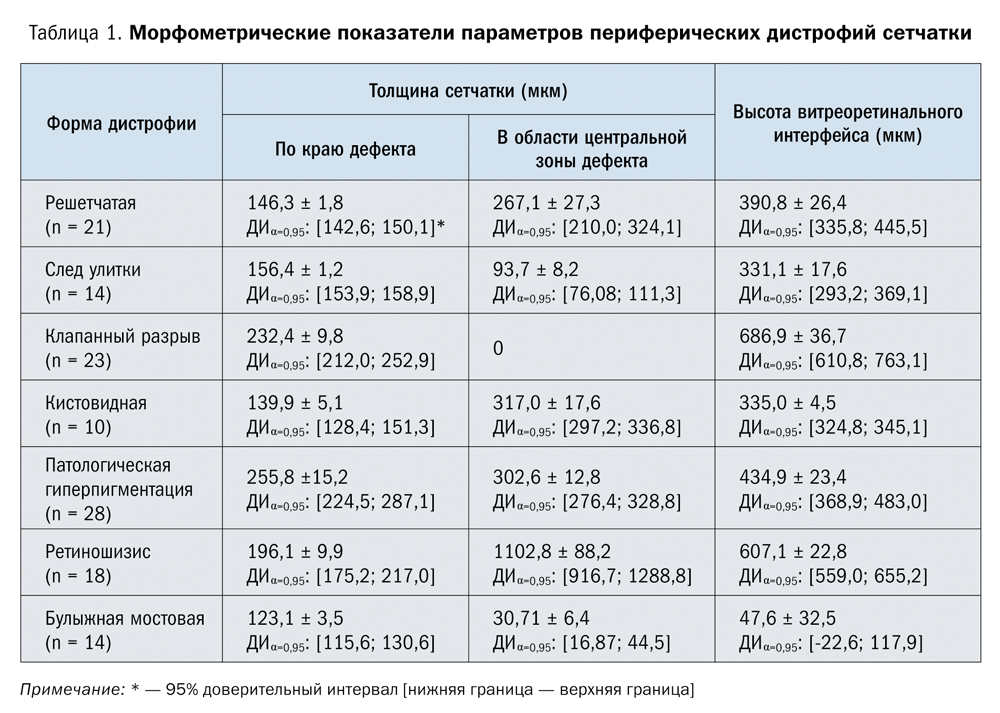
Проведен статистический анализ с использованием стандартного пакета программ статистического анализа «SPSS 11.0 for Windows» с обработкой данных методами вариационной статистики, включающими вычисление средних значений, стандартных отклонений, 95% доверительного интервала (нижняя граница — верхняя граница). Представлены следующие морфометрические параметры ряда периферических дистрофий сетчатки: толщина сетчатки по краю дефекта, в центральной зоне поражения, высота витреоретинального интерфейса (табл. 1).
Таким образом, оптическая когерентная томография периферических дистрофий сетчатки с применением RTVue-100 (OPTOVUE, США) позволяет провести качественную и количественную оценку структуры дефектов in vivo, морфометрические измерения толщины сетчатки в области поражения, определить наличие витреоретинальных тракций, протоколирование структурных изменений, мониторинг за состоянием дистрофических изменений. Данная работа является пилотным исследованием и открывает широкие возможности для дальнейшего продолжения исследований, разработки показаний к лазерным, хирургическим лечениям, наблюдения за эффективностью проводимой терапии.
Литература
1. Родин А.С. Биомикроретинометрия. Теоретические основы работы на оптическом когерентном томографе сетчатки и принципы интерпретации томографических изображений // Офтальмология. – 2006. – № 2. – С. 81-87.
2. Алпатов С.А., Щуко А.Г., Урнева Е.М., Малышев В.В. Возрастная макулярная дистрофия: руководство.М.: ГЭОТАР – Медиа, 2010. – 112 с.
3. Большунов А.В., Ильина Т.С., Родин А.С., Лихникевич Е.Н. Влияние факторов риска на терапевтическую эффективность отграничивающей лазерной коагуляции при периферических разрывах сетчатки // Офтальмохирургия и терапия. – 2001; 1: 1: 53-58.
4. Поздеева О.Г. Периферические витреохориоретинальные дистрофии у лиц молодого возраста: особенности клиники, диагностика, патогенез, комплексное лечение: Автореф. дис. … д-ра мед. наук. – М., 2005. – 39 с.
5. Тарутта Е.П. Акустическая плотность склеры как фактор прогноза развития периферических витреохориоретинальных дистрофий при миопии // Вестник офтальмологии. – 2013. – № 1. – С. 16-20.
6. Lewis H. Peripheral retinal degenerations and the risk of retinal detachment. Am J. Ophtalmol. 2003; 136 (1): 155-160.
7. McPherson A., O’Malley R., Beltangady S.S. Management of the fellow eyes of patients with rhegmatagenous retinal detachment. Ophthalmology. 1981; 61:7.
8. Нероев В.В., Захарова Г.Ю., Кондратьева Ю.П. Лазерная коагуляция ретиношизиса // VI Рос. общенац. офтальм. форум: Сб. науч. ст. – М., 2013. – С. 59-62.
9. Пасечникова Н.В. Лазерное лечение при патологии глазного дна. – Киев: «Наукова думка», 2007. – 207 с.
10. Kottow M. Peripheral retinal degenerations and breaks. Kottow Albrecht v. Graefes Arch. Ophtalmol. 1980;214: 53-60.
11. Kamppeter B.A., Jonas J.B. Optical coherence tomography of a peripheral retinal schisis with an outer retinal layer break. Acta Ophthalmol Scand. 2004; 82 (5): 574-575.
12. Ghazi N.G., Dibernardo C. et al. Optical Coherence Tomography of peripheral retinal lesions in enucleated human eye specimens with histologic correlation. Am J Ophthalmol 2006; 141 (4): 740-742.
13. Manjunath V., Taha M., Fujimoto J.G.,Duker J.S. Posterior lattice degeneration characterized by spectral domain optical coherence tomography. Retina. 2011; 31 (3): 492-496.
14. Cheng S.C., Lam C.S., Yap M.K. Retinal thickness in myopic and non-myopic eyes. Ophthalmic Physiol Opt. 2010; 30: 776-784.
15. Muni R.H., Kohly R.P., Charonis A.C., Lee T.C. Retinoschisis detected with handheld spectral-domain optical coherence tomography in neonates with advanced retino-pathy of prematurity. Arch Oph-thalmol. 2010; 128 (1): 57-62.
16. Stehouwer M., Verbraak F.D., de Vries H.R., van Leeuwen T.G. Scanning beyond the limits of standard OCT with a Fourier domain optical coherence tomography integrated into a slit lamp: the SL SCAN-1. Eye (Lond). 2011; 25 (1): 97-104.
17. Oster S.F., Mojana F., Freeman W.R. Spectral-domain optical coherence tomography imaging of postoperative scleral buckles. Retina. 2011; 31 (8): 1493—1499.
18. Kothari A., Narendran V., Saravanan V.R. In vivo sectional imaging of the retinal periphery using conventional optical coherence tomography systems. Indian J Oph-thalmol. 2012; 60: 235-9.
Страницы: 1 2