В.П. Еричев
ФГБНУ «НИИГБ»
Роль и значение нестероидных противовоспалительных лекарственных средств в современной офтальмологии трудно переоценить, особенно, когда речь идет о их применении в практике послеоперационной терапии.
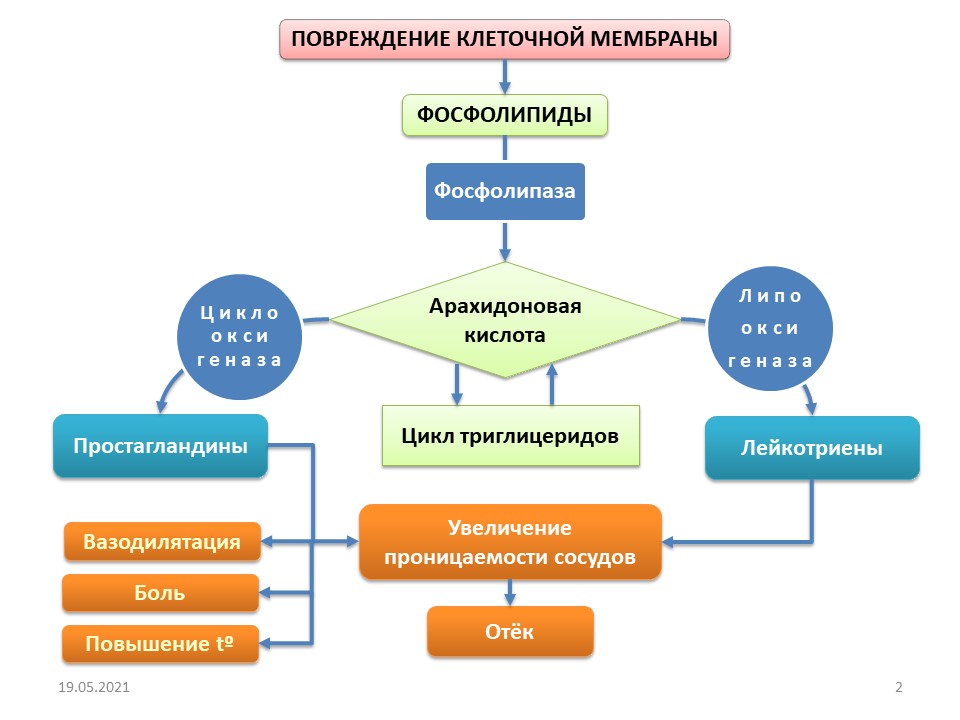
Известно, что в результате любого повреждения тканей, сопровождающееся нарушением клеточной мембраны, происходит образование фосфолипидов, представляющих собой фрагменты липидной оболочки поврежденных клеток. В этот момент запускается сложнейший каскад клеточных реакций. Фосфолипиды взаимодействуя с ферментом фосфолипазой с образованием арахидоновой кислоты. Дальнейшие преобразования могут пойти по двум сценариям, образуя цикл триглицеридов: взаимодействуя с цикооксигеназой I или II типа с образованием эндогенных простагландинов. Клинически это проявляется возникновением вазодилятации, боль, повышением температуры, увеличением проницаемости сосудов. Взаимодействие арахидоновой кислоты с другим ферментом ― липооксигеназой ― приводит к образованию лейкотриенов, ответственных за возникновение отека тканей и усиливая сосудистую проницаемость (рис. 1). А это и есть классический симптомокомплекс любого воспаления. В контексте сегодняшнего разговора речь идет об асептическом воспалении воспаление как комплексной местной реакции организма на повреждение тканей, проявляющейся в виде альтерации, экссудации и пролиферации
С точки зрения терапии такого состояния логично предположить возможность воздействия на любое звено этого каскада реакций, что, безусловно, приведет или может привести к снижению вероятности возникновения асептического воспаления и минимизации возможных последствий воздействия медиаторов воспаления.
В качестве таких агентов рассматривают кортикостероидные и нестероидные противовоспалительные средства (НПВС).
Кортикостероиды действуют на более раннем этапе развития воспалительной реакции ― на этапе взаимодействия фосфолипидов с фосфолипазой. А НПВС прерывают реакцию взаимодействия циклооксигеназы и арахидоновой кислоты. Было бы логичным предположить, что с точки зрения терапевтической эффективности предпочтительно более раннее вмешательство, и оно связано с использованием именно кортикостероидов. Однако результаты сравнительных исследований терапевтического действия кортикостероидов и НПВС показали, что по таким критериям, как противовоспалительный, анальгезирующий эффект и другие факторы воздействия НПВС оказывают более выраженный эффект, в том числе достаточно энергично ингибируют воздействие медиаторов воспаления на сфинктер радужной оболочки, предупреждая возникновение миоза.
Действие кортикостероидов ограничивается лишь выраженным противовоспалительным эффектом, они практически не оказывают анальгезирующего эффекта и крайне слабо предупреждают возникновение миоза, что особенно важно при таких операциях, как факоэмульсификация.
Преимущества НПВС перед кортикостероидами выражаются также в минимальном количестве побочных действий. Применение же кортикостероидов способно вызвать повышение внутриглазного давления (ВГД), привести к замедлению эпителизации; в ряде случаев описывают достаточно интенсивное развитие катаракты как следствие прямого воздействия кортикостероидов.
Важное значение для купирования асептического воспаления, которое сопровождает любое хирургическое вмешательство и может повлиять на его исход, имеет выбор правильных и корректных подходов к лечению.
Компоненты асептического клинически проявляются в виде боли, светобоязни, слезотечения, эффекта Тиндаля, миоза, повышение ВГД, в ряде случаев может развиться кистозный макулярный отек.
Выброс простагландинов при любом хирургическом вмешательстве в контексте асептического воспаления вызывает нарушение гематоофтальмического и гематоретинального барьеров, оказывает влияние на сфинктер радужной оболочки и нервные окончания роговицы, проявляющееся в виде болевого синдрома, светобоязни, слезотечения, провоцируют подъем ВГД.
Простагландины за очень короткое время вызывают нарушение гематоофтальмического барьера, провоцируют нарушение прницаемости сосудистой стенки. Это нарушение проницаемости позволяет протеиновым и воспалительным клеткам проникать в переднюю камеру глаза, что при осмотре в свете щелевой лампой определяется как опалесценция влаги передней камеры или эффект Тиндаля.
Нарушение проницаемости сосудов, вызванное простагландинами, нарушает так же гематоретинальный барьер с возможным исходом в кистозный макулярный отек. Последний является результатом скопления жидкости в слоях сетчатки заднего полюса глазного яблока. Если эти изменения продолжаются длительный период, они могут вызвать функциональные нарушения. Кистозный макулярный отек как и синдром Ирвина-Гасса – это серьезное послеоперационное осложнение после экстракции катаракты, особенно без имплантации искусственного хрусталика.
К этому осложнению могут приводить не только эндогенные простагландины, возникающие при хирургическом вмешательстве, но и экзогенные простагландины, которые в виде топической терапии нередко применяют для снижения ВГД. В связи с этим купирование послеоперационной офтальмогипертензии с применением экзогенных простагландинов необходимо проводить с осторожностью.
Реакция на операционную травму связана не только с образованием в зоне хирургического вмешательства простагландинов, но и других биологически активных веществ таких, как нейропептиды, ацетилхолин, субстанция Р – специфический медиатор, вызывающий особенно выраженное действие на сфинктер радужной оболочки, вызывая миоз. А сужение зрачка во время операции является серьезным осложняющим фактором как на ее этапах, так и в послеоперационном периоде, повышая риски развития осложнений. Эти же факторы через воздействие на нервные окончания роговой оболочки и вызывают болевой синдром, слезотечение, светобоязнь особенно при кераторефракционных операциях с использованием лареров.
Результатом нарушения гематоофтальмического барьера является и повышение ВГД как результат обструкции дренажной системы, вызванной проникновение во влагу передней камеры протеинов, воспалительных клеток, других депозитов, так и отеком трабекулярной ткани.
Хорошо известен и симптом гиперемии конъюнктивы, связанный с вазодилятацией, вызванной действием простагландинов и лейкотриенов.
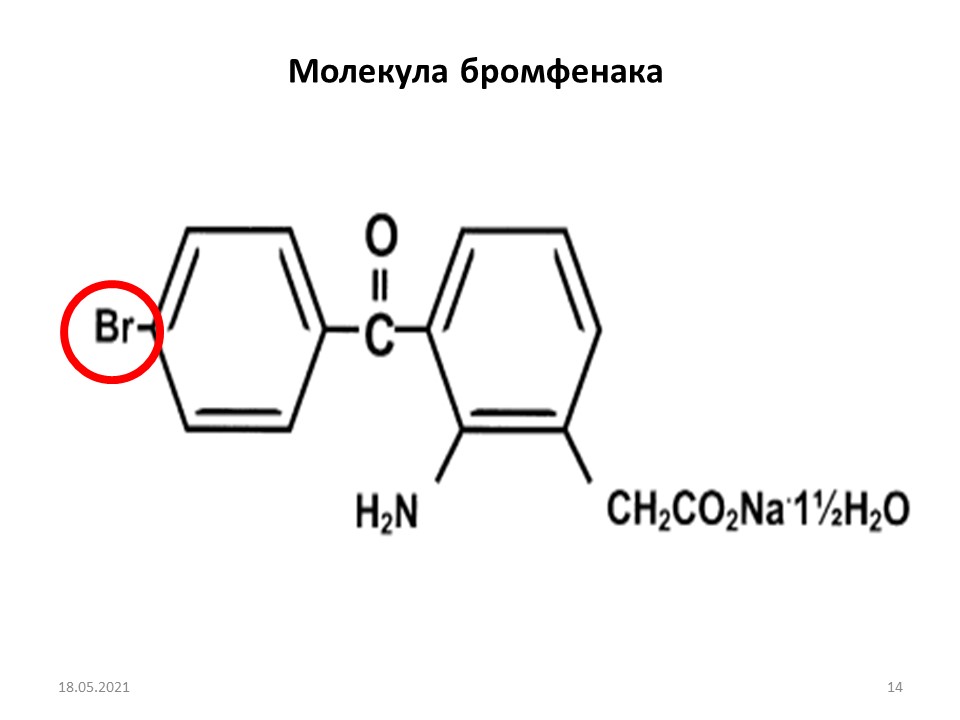
Развитие раневого процесса, где одним из основных факторов является аспетическое воспаление, диктует необходимость медикаментозного воздействия на этапах его клинического проявления. В начале XXI века для купирования асептического воспаления был предложен нестероидный противовоспалительный препарат для применения в офтальмологии ‒ бромфенак, разработанный японской компанией Senju. Этот препарат применяется не только для терапии в послеоперационном периоде, но и для симптоматического лечения при таких воспалительных состояниях, как блефарит, конъюнктивит, склерит, эписклерит, а также при дополнительной терапии при возрастной макулярной дегенерации.
Для повышения терапевтической эффективности базовая формула бромфенака была усилена атомом брома (рис. 2). Включение брома обеспечивает усиление липофильности молекулы, что способствует повышению скорости и глубины проникновения; продлевает анальгезирующее и противовоспалительное действие; увеличивает подавляющее действие на циклооксигеназу, особенно второго типа...
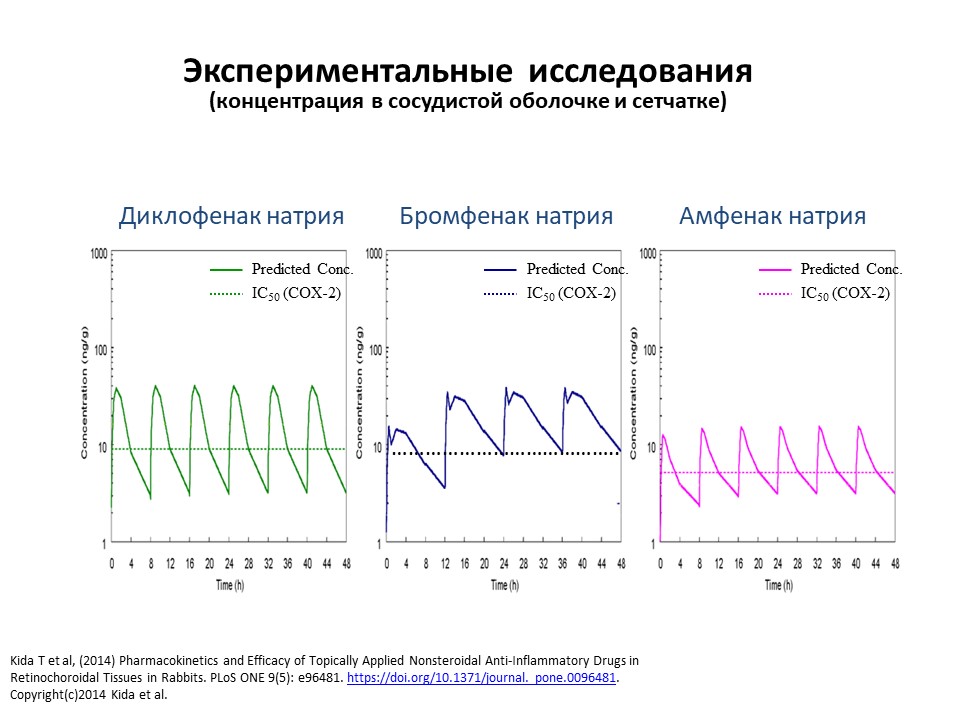
Проведенные экспериментальные исследования подтвердили значительный терапевтический эффект бромфенака по сравнению с аналогичными препаратами (рис. 3). Пиковые значения концентрации бромфенака в эксперименте превышали критическую линию, что свидетельствовало о более высокой терапевтической эффективности препарата.
Доклинические исследования, проведенные на репрезентативной группе добровольцев, показали, что препарат практически полностью ингибировал повышенное содержание белка в водянистой влаге после парацентеза или воздействия лазерным облучением. В высоких концентрациях бромфенак обнаруживался в роговице и конъюнктиве. Для оценки местного раздражающего действия бромфенак ежедневно в течение 4 недель вводили в глаза кроликам, при этом местное раздражающее действие препарата было незначительным. Бромфенак не обладает репродуктивной или тератогенной токсичностью.
В Японии было проведено многоцентровое, двойное слепое сравнительное исследование с активным контролем (пранопрофен) в терапии послеоперационного лечения.
Результаты показали, что общий уровень эффективности пранопрофена при постоперационном воспалении, по оценке исследователей, составил 67,6%, для бромфенака этот показатель соответствовал 83,8%.
Частота развития неблагоприятных побочных реакций (ADRs) в группе пранопрофена составила 1,8%, в группе бромфенака ‒ 0,9%.
На основании полученных данных, глазные капли бромфенак натрия гидрата 0,1% были оценены как эффективный и безопасный препарат при лечении воспаления переднего отрезка глаза при таких заболеваниях, как блефарит, склерит, эписклерит.
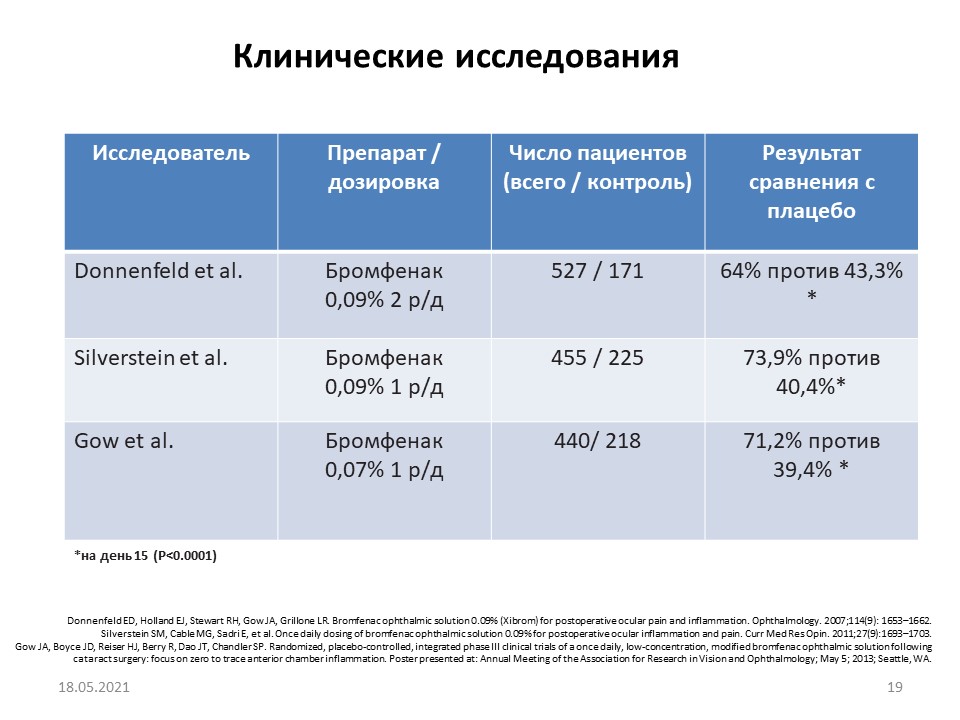
Клинические исследования, проведенные в различных офтальмологических центрах, также продемонстрировали высокую терапевтическую эффективность препарата бромфенак (рис.4). Это объясняется тем, что концентрация препарата в роговице и радужке превышает концентрацию сравниваемых препаратов той же фармакологической группы.
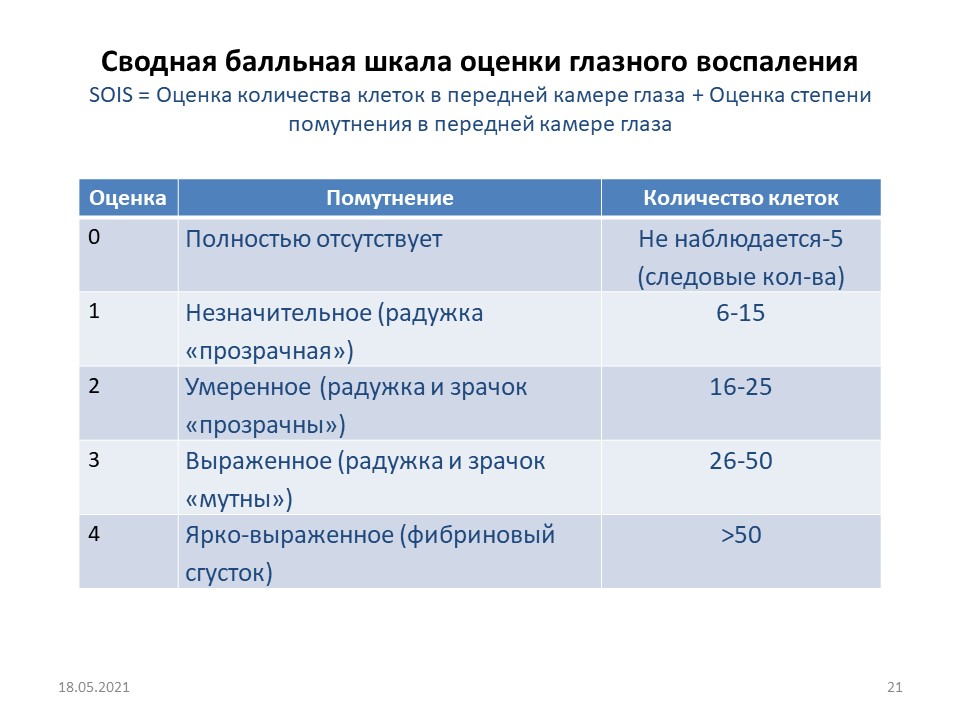
Для оценки терапевтической эффективности и глазного воспаления использовалась сводная бальная шкала SOIS (рис. 5). За основу была принята оценка состояния прозрачности влаги передней камеры от «незначительной опалесценции» до «выраженного фибринозного содержимого». Эта прозрачность зависила от количества попавших во влагу передней камеры в процессе асептического воспаления протеинов, воспалительных клеток, иных депозитов.
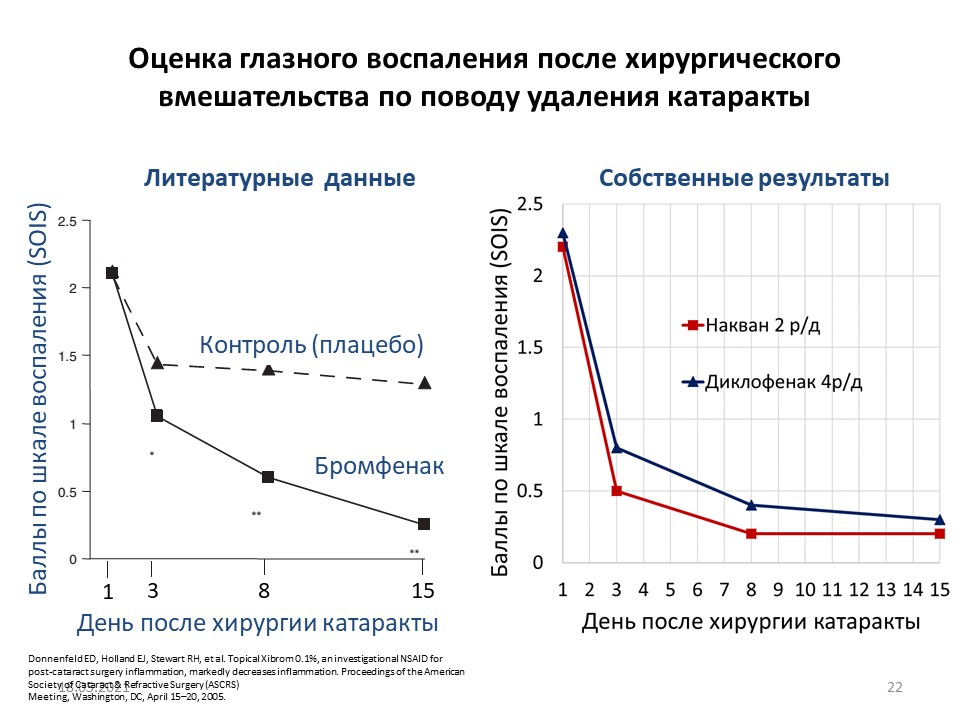
На рис. 6 показана преимущественная терапевтическая эффективность бромфенака (применение 2 раза в день) по сравнению с диклофенаком (применение 4 раза в день). При этом, по данным бальной оценки, в послеоперационном периоде при применении бромфенака получены более высокие цифры терапевтической эффективности.
По данным литературы, при оценке частоты и характера симптомов (рис. 7) по сравнению с группой контроля бромфенак в значительной степени оказался более эффективным препаратом.
На рис. 8 показаны результаты собственных исследований пациентов, которым была выполнена факоэмульсификация и пациенты в послеоперационном периоде получали инстилляции бромфенака в терапевтической дозе.
По данным Ю.Ф. Майчука, воспалительными заболеваниями переднего отрезка глаза ежегодно страдают 16 млн человек. На такие заболевания, как блефарит, склерит, эпислерит, кератит, увеит приходится около 40% первичного приема, временная нетрудоспособность достигает 80%, многие пациенты нуждаются в госпитальном лечении, некоторые случаи могут быть причиной слабовидения и слепоты.
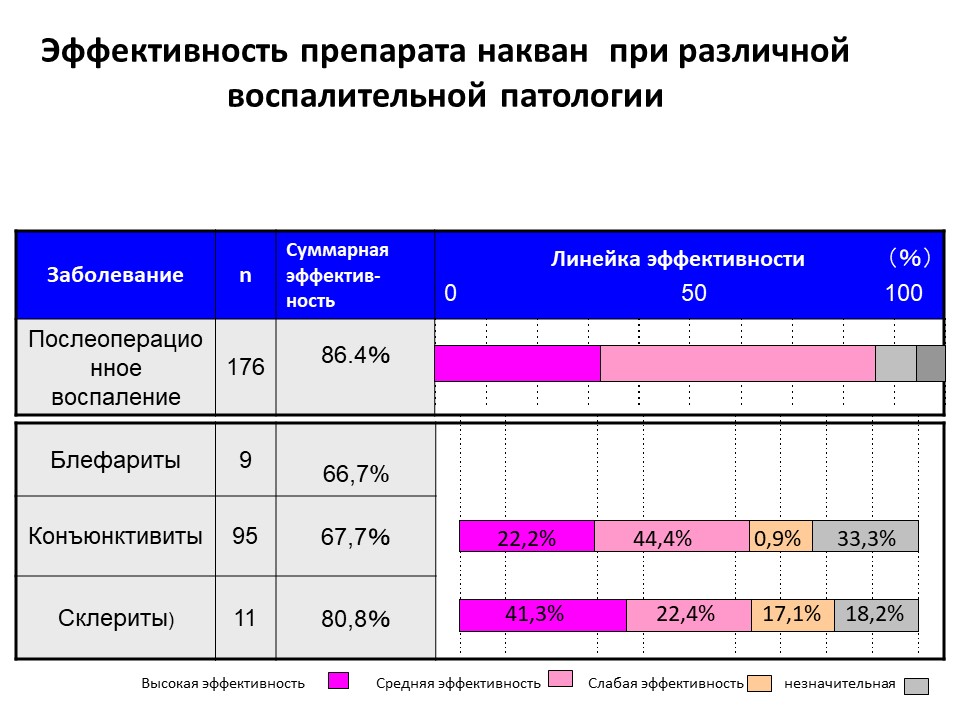
Клиническая эффективность применяемого в таких случаях бромфенака в виде инстилляций наквана составляет, по литературным данным, 77,3%, при этом высокая терапевтическая эффективность препарата была зафиксирована в 31,3% случаев при лечении склерита и эписклерита. Аналогичные результаты были получены при лечении и послеоперационного воспаления (рис. 9).
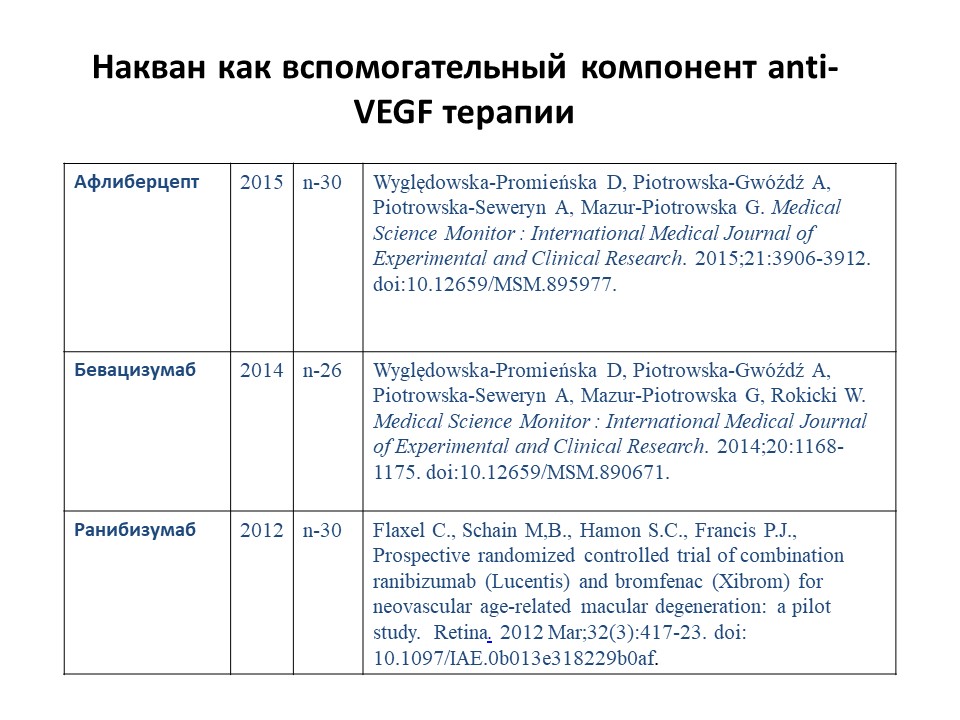
Особый интерес может представлять применение наквана в качестве вспомогательного препарата при интравитреальном введении анти-VEGF препаратов при лечении возрастной макулярной дегенерации с применением ингибиторов ангиогенеза рис. 10).
Пилотные исследования показали, что применение наквана как вспомогательного компонента анти-VEGF терапии позволяет уменеьшить частоту интравитреальных инъекций при сохранении высокой эффективности лечения. Этот фактор не только с медицинской, но и с экономической точки зрения является существенным.
Препарат накван обладает выраженным противовоспалительным и анальгезирующим эффектом у пациентов, перенесших такие операции как факоэмульсификация, антиглаукомные вмешательства, лазерные кераторефракционные операции. Благодаря хорошей переносимости и удобства применения (частота инстилляций два раза в день), незначительное число нежелательных явлений, применение препарата накван повышает комплаентность и приверженность пациентов лечению.