Конгресс Азиатско-Тихоокеанской Академии Офтальмологии (Asia Pacific-Ocean Academy Ophthalmology Congress, APAO) — ежегодное мероприятие, проходящее под эгидой Международного Офтальмологического Совета (International Council of Ophthalmology, ICO), собирающее офтальмологов со всего мира.

Доклад профессора Наталии Курышевой
На 34-м Конгрессе APAO присутствовали 6 тысяч делегатов из 85 стран. Место проведения — Национальный выставочный центр Королевы Сирикит (Queen Sirikit National Convention Center (QSNCC) в Бангкоке (Таиланд). Цель мероприятия — объединить усилия по инновациям и технологиям лечения глазных заболеваний в Европе и Азии. Несмотря на то что на конгрессе присутствовало большое количество офтальмологов из Китая, Индии и других стран Азиатско-Тихоокеанского региона, значительное место в программе заняли доклады ведущих экспертов из США, Европы, Японии и других стран, касающиеся всех направлений офтальмологии.
Заседания проходили в виде пленарных сессий в четырех крупных залах на 500 человек и в виде сателлитов и симпозиумов в 30 залах на 200 человек.
На конгрессе были представлены доклады по «живой хирургии», разбирались многочисленные клинические случаи. На пленарных заседаниях акцент был сделан на новейшие технологии и перспективы в лечении и диагностике глазных заболеваний, а также на образовательные аспекты, направленные на повышение квалификации практикующих офтальмологов.
Многие заседания были посвящены проблемам здравоохранения в развивающихся странах и в мире в целом. В частности, рассматривалась проблема обеспечения высокотехнологичной офтальмологической помощью провинций в Таиланде, Вьетнаме, Китае и Индии.
Большое внимание было уделено проблемам образования и освоения хирургической техники молодыми специалистами. С этой целью были развернуты ветлабы, где доктора могли совершенствовать свои хирургические навыки.
В крупном выставочном комплексе были представлены все виды новейшего офтальмологического диагностического и хирургического оборудования.
Настоящий обзор охватывает информацию, прозвучавшую на заседаниях, посвященных глаукоме.
На сессии «Визуализация переднего отрезка глаза» большой интерес вызвал доклад профессора Л. Шметтерера (Сингапур-Австрия), в котором автор остановился на новой технологии, основанной на использовании конической сканирующей системы, позволяющей с особой четкостью видеть периферию роговицы и боковые проекции шлеммова канала (ШК). В основе данной системы — использование света с высокой проницаемостью, что дает возможность получить чрезвычайно высокое разрешение (до 1,2 мк). При этом достигается качественная визуализация ШК, склерального венозного плексуса и склеральной шпоры. Автором была продемонстрирована 3D-реконструкция ШК. Перспективы использования данной системы весьма многообещающие, особенно с точки зрения исследования новых препаратов, улучшающих отток внутриглазной жидкости, а также новых технологий микроинвазивной хирургии глаукомы.
В докладе, посвященном новой технологии гониоскопии, профессор А. Гоммер (Австрия) указал на важность визуализации угла передней камеры (УПК). И хотя метод гониоскопии был предложен еще в 1914 г., никакие прочие методики на сегодняшний день не могут его заменить. Автор подчеркнул, что даже в развитых странах Европы, таких как Австрия, при диагностике глаукомы остроту зрения исследуют в 96% случаев, однако УПК смотрят только в 45% случаев. В результате 80% офтальмологов не могут правильно поставить диагноз закрытоугольной глаукомы (ПЗУГ), поскольку не проводят гониоскопию.
А. Гоммер (Австрия): «В развитых странах, таких как Австрия, 80% офтальмологов не могут правильно поставить диагноз закрытоугольной глаукомы (ПЗУГ), поскольку не проводят гониоскопию».
Между тем именно гониоскопия позволяет выбрать правильный метод лечения: при наличии гониосинехий становится очевидной необходимость проведения синустрабекулэктомии или удаления хрусталика.
В докладе М. Хе (Сингапур) автор остановился также на результатах недавно проведенного многоцентрового исследования, целью которого явилось выяснение целесообразности выполнения профилактической лазерной иридотомии (ЛИТ) как метода профилактики ПЗУГ. Исследование проводилось в США и Сингапуре; в нем приняли участие 986 больных, которых наблюдали 6 лет. Сравнивали две группы пациентов: в первой группе выполнялась профилактическая ЛИТ, во второй группе ЛИТ не выполнялась. Результаты показали, что ЛИТ предотвращает развитие ПЗУГ в половине случаев. Однако число случаев перехода подозрения на ПЗУГ в ПЗУГ очень невелико (порядка 11%), поэтому для предотвращения одного случая развития ПЗУГ в течение 6 лет необходимо провести 44 процедуры ЛИТ, что не оправдано ни с медицинской, ни с экономической точки зрения. В результате этого исследования впервые был сделан вывод о нецелесообразности проведения профилактической ЛИТ.
В продолжение данного доклада возникла дискуссия о том, что лучше делать при ПЗУГ — удалять хрусталик или сочетать эту операцию с гониосинехиолизисом.
Профессор Гоммер сослался на недавнее Сингапурское исследование, цель которого заключалась в попытке ответить на этот вопрос. Оказалось, что различия в результатах первой и второй хирургической опции не наблюдалось. Также не было замечено различия в результатах проведения ЛИТ в разных локализациях (в височном или носовом секторах) с точки зрения профилактики дисфотопсии. Об этом рассказал профессор Р. Венкатэша (Индия), который привел результаты многоцентрового исследования, проведенного в Индии на 556 пациентах.
Профессор Дж. Либманн (США): «Какой смысл при подозрении на глаукому делать периметрию каждые полгода? Пора заменить ее оптической когерентной томографией и наблюдать за ганглиозными клетками сетчатки в макулярной области».
На данной секции большое внимание было уделено ОКТ для переднего отрезка глаза. Благодаря этой методике удалось выяснить, что важным фактором риска повышенного ВГД при ПЗУГ является толщина радужки, что особенно проявляется при расширении зрачка. Именно от этого параметра зависит эффективность ЛИТ. В докладе Дж. Ким (Китай) было подчеркнуто, что использование данного метода визуализации изменило представление о классификации ПЗУГ и механизмах закрытия УПК. Был введен новый параметр оценки — объем передней камеры. Оказалось, что он более информативен, чем ее глубина. Все указанные аспекты были учтены при создании современной классификации закрыто-угольной глаукомы.
В докладе К. Парк (Южная Корея) основной акцент был сделан на исследовании макулярной зоны в ранней диагностике глаукомы. По мнению автора, ганглиозные клетки (ГКС), расположенные вдоль горизонтального шва в макулярной зоне, поражаются особенно рано, и их изменения могут быть выявлены раньше, чем поражение слоя нервных волокон сетчатки. Это важно как с точки зрения ранней диагностики заболевания, так и наблюдения в динамике (рис. 1).
Эту идею поддержал профессор Дж. Либман (США), который отметил крайне низкую надежность периметрии (САП) в выявлении глаукомы. Автор заявил: «Какой смысл при подозрении на глаукому делать периметрию каждые полгода? Пора заменить ее оптической когерентной томографией и наблюдать за ганглиозными клетками сетчатки в макулярной области».
В настоящее время существуют таблицы, показывающие когда можно ожидать появления дефектов поля зрения при соответствующих изменениях в СНВС, ДЗН и макулы. Таким образом, нет необходимости проводить САП и повторять ее при подозрении на глаукому, необходимо делать ОКТ и смотреть за макулой. В ближайшей перспективе, по мнению автора, вся диагностика глаукомы будет сведена к визуализации СНВС, ГКС, решетчатой мембраны и геморрагий на ДЗН.
В докладе Н. Гупта (Канада) автор остановилась на лимфатических сосудах, которые были идентифицированы в цилиарном теле в экспериментах на животных (овцах, крысах) при помощи специальных радио-активных наночастиц (Radiactive Tracer Studies), отражающих ток лимфы по этим сосудам (рис. 2). Введение экспериментальным животным наночастиц в переднюю камеру позволяло обнаружить их уже через 20 минут в шейных лимфатических сосудах, причем именно со стороны экспериментального глаза. Частицы сохранялись до 6 часов. Отток, по мнению исследователей, регулируется особыми клетками в цилиарных волокнах, которые атрофируются с возрастом. Авторы также показали, что лимфоотток усиливается аналогами простагландинов. Однако, по мнению Гупта, открытие интраокулярных лимфатических сосудов ставит больше вопросов, чем ответов, так как заставляет задуматься о патогенезе иммунных, воспалительных и онкологических заболеваний глаза. Безусловно, обнаруженный новый путь оттока жидкости из глаза открывает новые возможности в лечении глаукомы.
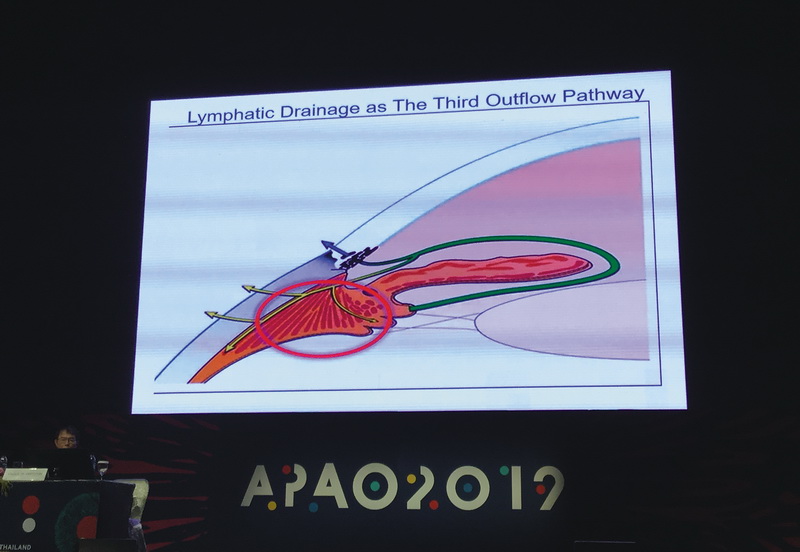
Рис. 2. Направление лимфатического оттока
в глазу
Автор также остановилась на недавнем открытии, сделанном группой исследователей из Торонто, показавшем возможность проникновения спинномозговой жидкости в зрительный нерв по особым каналам через мягкую мозговую оболочку по перивазальным пространствам. Это так называемый «Г-лимфатический путь», так как в нем активно участвуют астроциты. Существованием этого пути авторы объясняют отек зрительного нерва, возникающий у астронавтов.
Н. Гупта (Канада): «Открытие интраокулярных лимфатических сосудов ставит больше вопросов, чем ответов, так как заставляет задуматься о патогенезе иммунных, воспалительных и онкологических заболеваний глаза. Безусловно, обнаруженный новый путь оттока жидкости из глаза открывает новые возможности в лечении глаукомы».
С другой стороны, нарушение в функционировании этого пути, выявленное недавно авторами при экспериментальной глаукоме, может оказаться новым патогенетическим механизмом при данном заболевании.
Одним из важных заседаний, посвященных глаукоме, явился симпозиум «Новейшие разработки в области визуализирующих технологий при глаукоме» (Emerging Ocular Imaging Technologies).







