Д.Ю. Майчук
ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»
Успех результатов хирургии катаракты основывается не только на применении самых современных и безопасных технологий интраоперационного этапа, но и во многом зависит от внедрения рациональных схем медикаментозного сопровождения как до, так и после хирургии катаракты. Стандартизация подходов к фармакологическому сопровождению современной хирургии катаракты дает возможность избежать ряда осложнений и закрепить успех интраоперационных высокотехнологичных манипуляций.
Выбор режима дозирования инстилляций в рекомендациях ESCRS 2007 года
Однако четкой и единой позиции по данным современных исследований в вопросе периоперационной фармакотерапии нет. В недавнем прошлом единственным опубликованным и принятым к повседневной практике руководством являлись «Рекомендации Европейского Общества катарактальных и рефракционных хирургов по профилактике, изучению и ведению послеоперационных эндофтальмитов» (ESCRS Guidelines on prevention, investigation and management of post-operative endophthalmitis. Version 2. 2007).
В данных рекомендациях указывалась следующая схема ведения пациентов, поступающих на хирургию катаракты:
До операции: 1 капля 4 раза в день за 24-48 часов до операции или 1 капля за 1 час и за 30 минут до операции;
Сразу после операции: 1 капля сразу после операции, спустя 5 минут и еще спустя 5 минут;
В послеоперационном периоде: 1 капля каждые 1-2 часа в день операции и начиная со следующего дня: 1 капля 4 раза в день в течение 1-2 недель.
Выбор антибиотика для инстилляций в рекомендациях ESCRS 2007 года
При этом выбор антибиотика был отдан в пользу фторхинолонов 2 и 3-го поколений: левофлоксацин (торговое наименование в РФ — офтаквикс, глазные капли 0,5% «Сантэн», Финляндия) и офлоксацин (торговое наименование в РФ — флоксал, глазные капли 0,3%). Обоснование этого выбора связано было, прежде всего, с особенностями профилактической местной антибиотикотерапии в офтальмологии — необходимость применения антибиотиков с минимальной резистентностью, хорошей переносимостью и быстрым набором минимальной ингибирующей концентрации (ESCRS Endophthalmitis Study Group: Prophylaxis of post-operative endophthalmitis following cataract surgery: results of the ESCRS multi-centre study and identification of risk factors // J. Cataract Refract Surg. – 2007. – V. 33. – P. 978-988).
Однако для профилактической местной антибиотикотерапии в офтальмологии наиболее важное значение имеет широкий спектр эффективности, т.е. равноценная эффективность в отношении как грам(+), так и грам(-) микрофлоры. При этом отдельное место занимает так называемая «внутрибольничная инфекция», представленная синегнойной палочкой (Pseudomonas aeruginosa) (табл. 1).
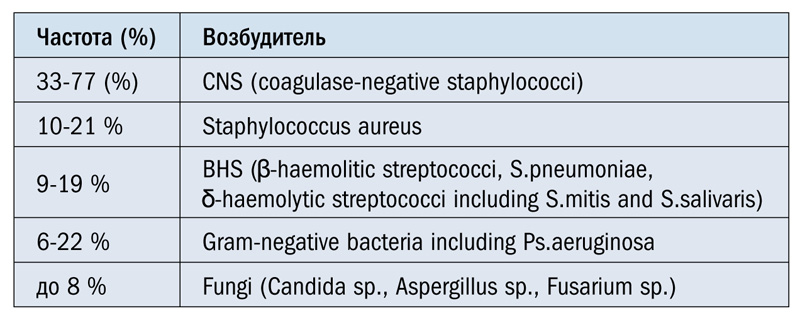
Табл.1. Наиболее часто определяемые микроорганизмы, вызывающие послеоперационные эндофтальмиты. Сводный анализ Руководства ESCRS 2013 г.
Особое внимание эффективности антибиотика в отношении именно Pseudomonas aeruginosa обусловлено, прежде всего, крайней агрессивностью этого возбудителя и очень быстрым развитием воспалительного процесса, способного привести к тяжелому эндофтальмиту менее чем за сутки. В начале 90-х годов фторхинолоны 2-го поколения (такие как офлоксацин) именно из-за своей способности активно подавлять рост синегнойной палочки и одновременно имеющие сбалансированный спектр активности как в отношении грам(+), так и грам(-) штаммов, заняли одно из основных мест в профилактике эндофтальмитов. Появление фторхинолонов 3-го поколения, левофлоксацин (офтаквикс, АО «Сантэн», Финляндия), не уступающих по спектру активности 2-му, естественно предопределило их использование для профилактики эндофтальмитов (Seal D.V., Barry P., Gettinby G. et al. ESCRS study of prophylaxis of post-operative endoph-thalmitis after cataract surgery: Case for a European multi-centre study // J. Cataract Refract Surg. – 2006. – V. 32. – P. 396-406).
Почему в Европе не получили приоритетность фторхинолоны 4-го поколения?
Следующее, 4-е поколение, фторхинолонов создавалось для оптимизации борьбы с антибиотикорезистентными грам(+) штаммами, и они оптимальны в лечении уже возникших инфекционных заболеваний переднего отрезка глаза преимущественно в условиях амбулаторного приема. Это достигается присутствием метокси-группы в положении 8, что способствует повышению активности и снижению возникновения резистентных мутантных штаммов грамположительных бактерий. А также присоединение дополнительного кольца в 7 положении предупреждает активный выброс (эффлюкс) фторхинолонов из клетки, связанный с генами NorA или pmrA, наблюдаемый у определенных грамположительных бактерий. 4-е поколение фторхинолонов активно используется в профилактике эндофтальмитов в катарактальной хирургии преимущественно в Северной Америке. Подобное географическое предубеждение определяется значительно большим, в сравнении с другими странами, количеством амбулаторной хирургии и соответственно большим риском возникновения стафилококковой контаминации, т.е. заражением «бытовой» микрофлорой (Moshirfar M., Feiz V., Vitale A.T et al. Endophthalmitis after uncomplicated cataract surgery with the use of fourth-generation fluoroquinolones – a retrospective observational case series // Ophthalmology. – 2007. – V. 114. – P. 686-691).
Издание руководства ESCRS 2013 года — приоритет левофлоксацина
Однако вступившее в силу в 2013 году новое практическое руководство ESCRS по профилактике эндофтальмитов еще раз подняло проблему неоднозначности периоперационного ведения пациентов, поступающих на хирургию катаракты. Эта неоднозначность отражена в статусе руководства, где оговаривается его рекомендательный характер («Данные, дилеммы и выводы») в отличие от предыдущего Руководства 2007 года (рис. 1). При этом выбор инстилляционного антибиотика остался неизменным в пользу фторхинолона 3-го поколения — левофлоксацина (офтаквикс). Отсутствие в новой версии руководства офлоксацина основано на данных исследований, где было доказано его более медленное достижение минимальной ингибирующей концентрации во влаге передней камеры глаза по сравнению с левофлоксацином (Holland E.J. New Options for Preventing Infection // Ocular Surgery News. – Sept., 2002. – P. 5-6) (рис. 2). Помимо спектра антимикробного воздействия, необходимо учитывать возможность быстрого достижения эффективной концентрации препарата в роговице, т.е. минимальной ингибирующей концентрации, не вызывая при этом токсической реакции в и без того подвергшихся хирургической травме тканях глаза. Так, концентрация левофлоксацина при однократной инстилляции значительно превосходит минимальную ингибирующую концентрацию для большинства микроорганизмов, вызывающих инфекционное поражение глаза (Healy D.P., Holland E.J., Nordlund M.L. et al. Concentrations of levofloxacin, ofloxacin, and ciprofloxacin in human corneal stromal tissue and aqueous humor after topical administration // Cornea. – Apr., 2004. – V. 23. – No. 3. – P. 255-263). Наравне с этим большую роль играет не только достижение, но и длительное поддержание минимальной ингибирующей концентрации в слезе. Так в случае левофлоксацина минимальная ингибирующая концентрация для большинства микроорганизмов сохраняется в течение 6 часов после инстилляции. В том числе и в отношении синегнойной палочки (Sundelin K., Seal D., Gardner S. et al. Increased anterior chamber penetration of topical levofloxacin 0.5% after pulsed dosing in cataract patients // Acta Ophthalmol. – 2009. – V. 87. – No. 2 . – P. 160-165).

Рис. 2. Концентрации левофлоксацина и офлоксацина в водянистой влаге (Holland E.J. New Options for Preventing Infection // Ocular Surgery News. – Sept., 2002. – P. 5-6)
Обоснование введения цефуроксима в переднюю камеру — основная тенденция руководства 2013 года
Принципиальное отличие содержания нового издания руководства заключается в настойчивой рекомендации введения цефуроксима в переднюю камеру глаза. Подобная рекомендация основывается на результатах исследования ESCRS, включавшего 16000 пациентов, в 23 центрах 9 стран Европы. Были сформированы следующие группы пациентов:
А — инстилляции плацебо;
В — инстилляции плацебо + интракамеральное введение цефуроксима;
С — инстилляции левофлоксацина;
D — инстилляции левофлоксацина + интракамеральное введение цефуроксима.
По результатам исследования были сделаны следующие выводы: в группе D уровень доказанных эндофтальмитов составил 0,025%, в группе С — 0,176%, в группе B — 0,049%, в группе А — 0,247% (рис. 3).
Однако применение интракамерального введения цефуроксима в Российской Федерации остается под вопросом в связи с 2-мя факторами. Во-первых, на дату написания работы в аннотации к препарату показаний к его применению для профилактики эндофтальмитов нет, и препарат не разрешен для введения интракамерально на территории Российской Федерации. Во-вторых, к цефуроксиму не чувствительны Pseudomonas spp, вызывающие особенно агрессивные и тяжелые эндофтальмиты. Кроме того, введение дополнительного ингредиента в переднюю камеру, особенно в конце операции, может потенцировать развитие токсико-аллергического синдрома. Соответственно при условии стационарного ведения пациентов с катарактами в России использование его как монотерапии опасно.
Применение других антибиотиков для введения в переднюю камеру
Применение других антибиотиков для введения в переднюю камеру также описано в литературе, однако для большинства из них существуют ограничивающие факторы. Ванкомицин является высоко эффективным против грамположительной, но весьма слабо эффективным против грамотрицательной инфекции. Соответственно данный антибиотик следует применять в случаях резистентной грамположительной микрофлоры, такой как стафилококковая инфекция, резистентная к фторхинолонам. Гентамицин в свою очередь обладает слабой эффективностью против P.acnes и стрептококков.
Опрос ESCRS, опубликованный в 2011 году, показал, что 66,3% опрошенных европейских хирургов практикуют введение антибиотиков в переднюю камеру. Из них 80,3% использовали цефуроксим, 12,9% — ванкомицин и 6,8% — моксифлоксацин.
Вывод
На основании анализа особенностей катарактальной хирургии в Российской практике и в соответствии с рекомендациями ESCRS логичным выбором местного инстилляционного антибиотика представляется применение глазных капель левофлоксацина (офтаквикса) по указанной выше схеме инстилляций до и после операции.








