Стенограмма доклада доцента Дж. Н. Ловпаче

Доцент Дж.Н. Ловпаче
«Возможность применения аналогов простагландинов у пациентов первичной открытоугольной глаукомой и возрастной макулярной дегенерации. Аргументы «за».
Увеличение средней продолжительности жизни в мире неизбежно повлечет за собой увеличение численности заболеваний с инволюционным вектором. К возраст-ассоциированным заболеваниям можно отнести первичную открытоугольную глаукому (ПОУГ) и возрастную макулярную дегенерацию (ВМД). Есть ли вероятность сочетания этих заболеваний и как руководствоваться выбором терапии в таких клинических ситуациях? Статистика свидетельствует о том, что в России около 1 миллиона больных глаукомой (906 человек на 100 тысяч населения), свыше 150 000 инвалидов по зрению и более 70 000 слепых вследствие глаукомы.
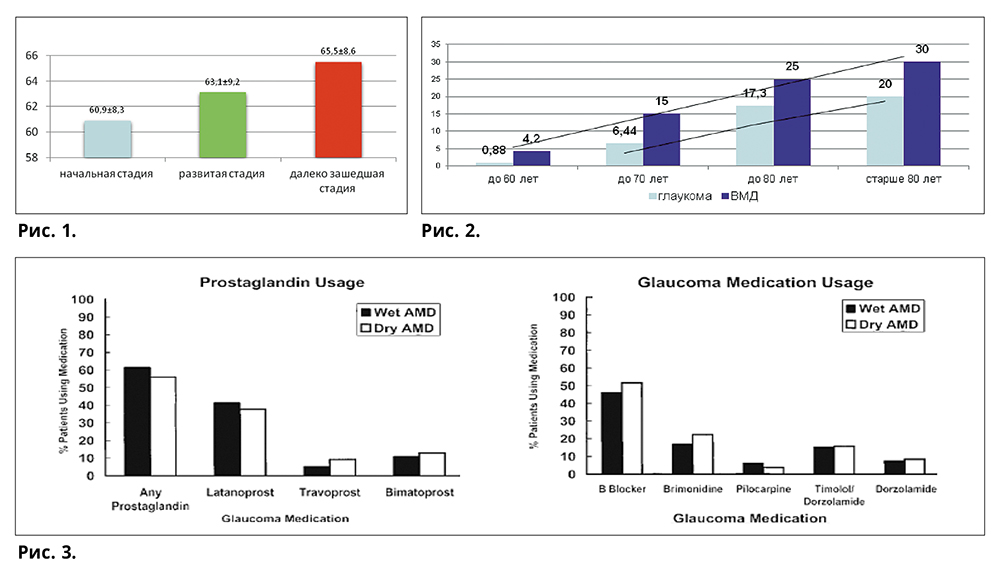
Почти во всех регионах России глаукома занимает первое место среди причин инвалидности вследствие офтальмопатологии. По данным ретроспективного эпидемиологического исследования (Киселева О.А. с соавт.), несмотря на длительное отсутствие симптомов болезни, первичная открыто-угольная глаукома диагностируется относительно часто — в начальной стадии в 43% и в развитой стадия — в 38% (рис. 1).
Вместе с тем по заключению ВОЗ возрастная макулярная дегенерация является одной из частых причин снижения зрения во второй половине жизни, ведущей к потере трудоспособности и ухудшению качества жизни людей. К 2050 году при росте численности населения Земли до 8,9 миллиардов предположительное число пациентов с ВМД составит 47 миллионов. Начальная стадия ВМД выявляется в пожилом возрасте (до 65 лет) — у 10-36,5%, поздняя стадия — у 0,5-3,3% людей старше 65 лет и у 9-12% лиц старше 80 лет. Двустороннее поражение при ВМД отмечается соответственно в 52-64 л. — 64%, 65-74 л. — 71%, в 75-85 л. — 79%. Влажная форма ВМД встречается значительно реже — в 10-15%, по сравнению с сухой формой, которая диагностируется в 85-90% случаев. Однако по «возрастному старту» отмечается несовпадение этих патологий. Исследованием группы «Научного авангарда» определен средний возраст и возрастная динамика (в %) пациентов на момент постановки диагноза (рис. 2). При «глаукоме» — это 59,92±0,58 (56; 64), при «ВМД» — 63,45±0,92 (59,5; 67).
Таким образом, цифры показывают не очень высокую вероятность параллельного начала этих двух заболеваний, хотя на момент постановки на учет (в среднем 61-64 г.), теоретическая, да и практическая возможность «встречи» этих двух патологических состояний существует. Это важно, так как возникает вопрос выбора терапии и возможного ограничения этого выбора с учетом побочных эффектов препаратов, и на практике возникает целый ряд вопросов.
Вопрос № 1: Есть ли реальная опасность применения для снижения ВГД препаратов группы аналогов простагландинов (АП) при наличии у пациентов ВМД, с учетом существующего мнения о не частом, но все же риске возникновения макулярного отека (МО) при применении этой группы препаратов?
Препараты группы аналогов простагландинов все чаще являются препаратами «старта», поскольку эффективно снижают внутриглазное давление при первичной открытоугольной глаукоме (ПОУГ) и хорошо переносятся пациентами. Механизм действия препаратов связан с активацией ферментной группы металлопротеиназ (ММП), а именно 1, 2, 3 и 9 подтипов в цилиарном теле, что является результатом перестройки внеклеточного матрикса (ВКМ) — вторичного явления после усиления выработки и активности ММП, что и лежит в основе усиления увеосклерального оттока и снижения внутриглазного давления. В нормальном физиологическом состоянии ММП играют важную роль в ангиогенезе, заживлении ран и перестройке ткани.
В норме неактивные формы ММП-2 и ММП-9, коллагеназы ММП-1 всегда
содержатся в мембране Бруха. Патологическая активность ММП связана с протеолитической деструкцией нормальной соединительной ткани. По мере старения уровень ММП-2 и ММП-9 в желтом пятне возрастает.
В глазах с ВМД уровень ММП-2 в межфоторецепторном матриксе сетчатки в два раза выше уровня в здоровых глазах. Предполагается, что ММП-2 и ММП-9 специфически влияют на образование ХНВМ. Поэтому вполне обоснованным будет теоретически предположить, что местное применение аналогов простагландинов действительно может влиять на данные ткани.
Вопрос № 2: Но насколько специфична и значима динамика уровней ММП именно для пациентов с ВМД?
Действительно есть высокая вероятность ассоциации подъема уровня MMP-2 и MMP-9 в плазме при развитии ВМД. Однако повышение уровня MMP-2 и MMP-9 в плазме также может быть следствием злокачественных новообразований, гепатитов, заболеваний легких, ревматоидного артрита, системного атеросклероза, повышения уровня С-реактивного белка и уровня провоспалительных цитокинов, стресса, расы, массы тела.
Поэтому все-таки нельзя утверждать, что динамика уровней ММП имеет высокую специфичность только для ВМД.
Вопрос № 3: Ну а тогда действительно ли связано длительное применение местных аналогов простагландинов с развитием хронической неоваскулярной мембраны (ХНВМ) у пациентов с глаукомой и сопутствующим диагнозом ВМД?
Учитывая активирующее действие АП (в исследовании — латанопроста) на ММП и предполагаемую роль ММП в образовании ХНВМ, изучалась и вероятность того, что местные простагландины, проявляя физиологическую активность в заднем отрезке глаза, могут вызывать образование ХНВМ у пациентов с ВМД. При применении АП пациентами с глаукомой в сочетании с влажной или сухой возрастной макулярной дегенерацией (ВМД) не было обнаружено существенных различий количества пациентов в каждой группе, получавших АП. При применении других местных антиглаукоматозных препаратов пациентами с влажной или сухой возрастной макулярной дегенерацией также не было обнаружено существенных различий в количестве пациентов (рис. 3).
Описано, что подтипы ММП в мембране Бруха нечувствительны к активации аналогами простагландинов. Простаноидные рецепторы во внутреннем и наружном слое сетчатки могут удалять молекулы простагландинов до того, как последние достигнут мембраны Бруха. Кроме того, наличие у псевдофакичных и факичных пациентов интраокулярной линзы или собственного хрусталика может служить дополнительным барьером, препятствующим поступлению АП в задний отрезок глаза. Таким образом, получается, что опасность применения этих препаратов условна?
Вопрос № 4: А насколько в таком случае безопасно применение АП в группах риска?..
При комбинации ВМД и ПОУГ, несмотря на достоверное уменьшение толщины наружных слоев сетчатки в макулярной области у больных ПОУГ в зависимости от стадий, не выявлено какой-либо закономерности между приемом отдельных гипотензивных препаратов или их комбинаций и тяжестью течения ВМД (Шутько Е.А.). У пациентов с сочетанием диабетической ангиопатии и ПОУГ толщина (и объем) сетчатки в макуле также достоверно отличалась только в зависимости от стадии ПОУГ. С нарастанием тяжести (стадии) глаукоматозного процесса отмечалось уменьшение толщины сетчатки (Григорьева Н.Н. с соавт.), что не зависело от применяемых групп препаратов местного гипотензивного действия. При этом дисперсионные (внутригрупповой и межгрупповой) типы анализов не установили статистически достоверных различий в состоянии макулярной зоны (толщины сетчатки) у пациентов в группе «ПОУГ» и группе «+ВМД» в зависимости от стадии заболевания (группа «Научный авангард»).
Вопрос № 5: Так все-таки ограничены ли мы в выборе?
Группа риска возникновения макулярного отека при применении препаратов группы АП, очевидно, действительно есть. Это пациенты, перенесшие тромбоз вен сетчатки, страдающие сахарным диабетом, пациенты после хирургии катаракты без осложнений и с интраоперационной потерей стекловидного тела, витреоретинальной тракцией, эпиретинальной мембраной, афакией, нарушением целостности задней капсулы. Среди обсуждаемых причин возникновения МО после хирургии катаракты описана, например, активация различных цитокинов, ферментов, эндотелиального фактора роста, продуктов распада арахидоновой кислоты, высвобождением простагландинов, включая и PGE2, что в комплексе вызывает нарушение гематоофтальмического барьера. Пожилой возраст тоже повышает «шансы» МО. Таким образом, препараты группы АП имеют «конкурентов», хотя и их роль в возможном возникновении МО полностью не исключается. Получается, четко определить причину возникновения МО невозможно. Но, даже в группе риска МО встречается в среднем не более чем
в 5% (Miltiadis K Tsilimbarisetall, 2008).Что же делать? Пациентам группы риска предложено приостановить инстилляции АП за 1 неделю до операции и вернуться ним через 30-60 дней после операции, если в этом есть реальная необходимость. ФЭК вызывает снижение ВГД — возможно в п/о периоде и не возникнет необходимости в АП, тем более что альтернатива по гипотензивной «силе» в арсенале есть (например, фиксированные комбинации, не содержащие АП) и лучше избегать вообще этой группы препаратов при послеоперационном реактивном синдроме. Рекомендовано сопровождать послеоперационный период стероидами и нестероидными препаратами, что, однако, давно уже является стандартом. Есть предположение и о роли консерванта бензалкония хлорида (БАК), который входит в состав большинства препаратов местной терапии в возникновении МО (в проведенном исследовании это касалось после хирургии катаракты). При применении тимолола в послеоперационном периоде достоверно более редкое возникновение МО отмечено при применении тимолола, не содержащего БАХ (David A. et all., 2010, 2011). Авторы даже предложили термин «pseudophakic preservative maculopathy» — артифакичная макулопатия, вызванная консервантами. Наличие препаратов местной гипотензивной терапии без БАК, включая также и TRAVATAN® раствор, содержащий антисептик ПОЛИКВАД® (0,001% поликватерниум-1) и Тафлотан® (0,0015% тафлупрост) без консерванта, позволяет снизить возможно гипотетический, но риск артифакичной макулопатии, вызванной консервантами.
Вопрос о причинно-следственной связи МО и препаратов группы АП является явно более сложным, чем первоначально можно предположить, явно неоднозначным и в настоящее время недоказанным. Но все же, сохраняя адекватную бдительность, скорее всего, следует сказать «да» аналогам простагландинов у больных с глаукомой и возрастной макулярной дегенерацией.
Страницы: 1 2