Профессор В.П. Еричев
Эксперты: доцент Дж.Н. Ловпаче (ФБГУ «МНИИ глазных болезней им. Гельмгольца», Москва), к.м.н. С.Ю. Петров (ФБГНУ «НИИГБ», Москва).
Модератор дискуссии, профессор В.П. Еричев, обратил внимание аудитории на то, что вокруг простагландинов идут серьезные споры в связи с возможным участием простагландинов в развитии макулярного отека, который может быть усилен в связи с основным заболеванием. Так это или не так — мнения у экспертов расходятся.
Стенограмма доклада к.м.н. С.Ю. Петрова
«Аналоги простагландинов (АП) у больных глаукомой и возрастной макулярной дегенерацией. Возможен ли компромисс?»

К.м.н. С.Ю. Петров
Простагландины впервые были выделены в 1935 году шведским физиологом фон Ойлером из семенной жидкости, получив название от лат. glandula prostatica. Позже было установлено, что простагландины синтезируются во многих тканях и органах.
Разнообразие функций и отсутствие в организме специального органа биосинтеза позволило относить их к т.н. «местным», или клеточным, гормонам.
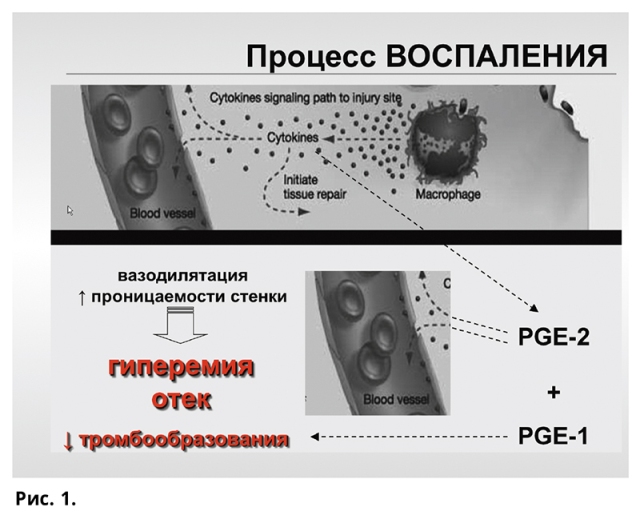
В начале ХХ века было известно, что экстракты половых желез животных и простаты человека понижают кровяное давление у собак и кроликов. В настоящее время известно около 30 природных простагландинов. Они разделены на группы A, B, C, D, E, F, G, I. Краткое обозначение складывается из аббревиатуры «PG» и группы, например, PGF — простагландин F. Среди множества эффектов выделяют важное свойство: расслабление гладкой мускулатуры. Вазодилатация и бронходилатация находят место в регуляции процессов нормальной физиологии, а расслабление гладкой мускулатуры — в патофизиологии. Активное участие простагландины принимают в регуляции местного воспалительного процесса, расширяя сосудистый просвет и повышая проницаемость стенки, что сопровождается гиперемией и отеком (рис. 1). По сути, вся проводимая по показаниям противовоспалительная терапия сводится к борьбе с синтезом простагландинов, поскольку стероидные препараты блокируют фосфолипазу, участвующую в трансформации фосфолипидов в арахидоновую кислоту, а нестероидные средства — циклооксигеназу, превращающую, в свою очередь, арахидоновую кислоту в простагландины. Таким образом, простагландины являются биологически активными веществами, способными вызывать, потенцировать и поддерживать звенья воспалительной реакции.
Макулярный отек (МО), впервые описанный Irvine в 1953 году после экстракции катаракты (ЭК), является скоплением жидкости в слоях сетчатки в центре возле фовеолы с образованием заполненных жидкостью образований. В 1982 году Jaffe и Daymen показали, что экстраксапсулярная ЭК вызывает развитие макулярного отека гораздо чаще, чем интракапсулярная. Причина данного явления — воспалительный ответ на хирургическую травму с активным синтезом простагландинов, что было доказано в работах K. Miyake, S. Sugiyama и I. Norimatsu. Позже A. Flach отметил снижение концентрации простагландинов, коррелирующее с уменьшением макулярного отека при терапии нестероидными противовоспалительными средствами.
Позже были сформулированы основные факторы риска развития макулярного отека: патология сосудов сетчатки (диабетическая ретинопатия, окклюзия центральной вены сетчатки, идиоматическая телеангиэктазия, макроаневризма центральной артерии сетчатки, радиационная ретинопатия), наличие внутриглазного воспаления (периферический увеит, ретинохориоидопатия, мультифокальный хориоидит с панувеитом, токсоплазмоз, цитомегаловирусный ретинит, болезнь Бехчета, клерит), состояние после удаления катаракты (имплантация интраокулярной линзы в переднюю камеру, вторичная имплантация, разрыв задней капсулы, выпадение стекловидного тела, диабет, кистозный макулярный отек в анамнезе на другом глазу), состояние после хирургических процедур (YAG-лазерная капсулотомия, криотерапия сетчатки, лазерная фотокоагуляция), состояние после приема лекарств (местное применение 2% адреналина, особенно в афакичном глазу, латанопроста и системное — никотиновой кислоты), а также дистрофии сетчатки, витреомакулярный тракционный синдром и макулярная эпиретинальная мембрана.
Таким образом, в настоящее время макулярный отек может рассматриваться как скопление жидкости в центре сетчатки, связанное преимущественно с синтезом простагландинов при воспалении хирургического и иного генеза.
Аналоги PGF2a, применяемые для снижения офтальмотонуса при глаукоме, как
известно, связываются с FP-рецепторами цилиарного тела, эпителия хрусталика, трабекулярного аппарата, меланоцитов радужки, а также волосяных фолликулов. Считается, что PGF2a увеличивают содержание матричных металлопротеаз, превращающихся в активные ферменты, разлагающие фибриллы коллагена. В результате чего происходит разрежение экстрацеллюлярного матрикса и увеличение увеосклерального оттока внутриглазной жидкости.
Принимая во внимание побочный эффект простагландинов — гиперемию, обусловленную вазодилятацией, их следует с осторожностью назначать при воспалении в анамнезе (ирит, увеит), а также при наличии дефекта задней капсулы хрусталика, Это нашло непосредственное отражение в инструкции по медицинскому применению латанопроста, где также указано на случаи макулярного отека (в т.ч. кистозного) на фоне терапии латанопростом преимущественно у пациентов с афакией, артифакией (с повреждением задней капсулы) и рисками макулярного отека. Также не рекомендуется применение препарата в стадии острого воспаления, к которой можно отнести и ранний послеоперационный период.
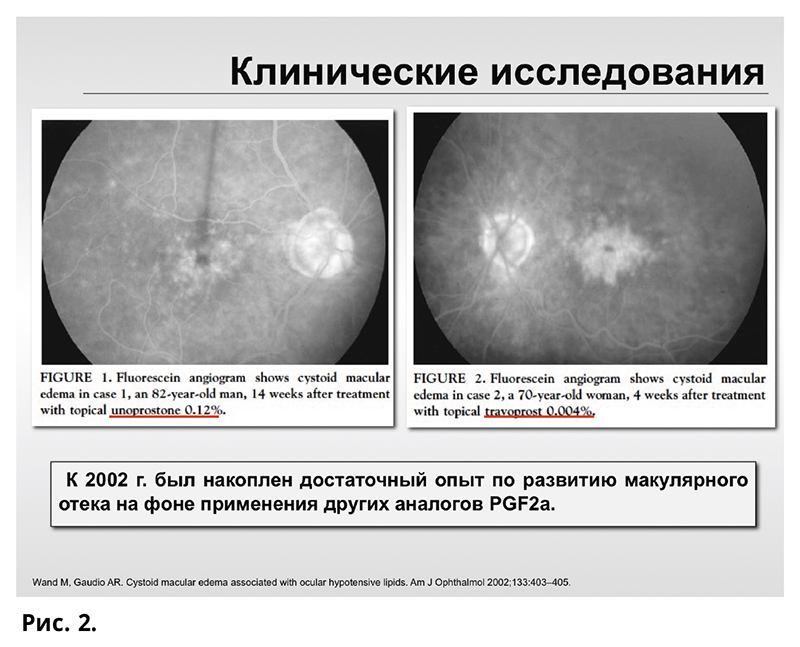
Сама по себе длительная местная гипотензивная терапия рассматривалась в качестве фактора риска макулярного отека при ЭК T. Krupin еще 1987 году. Спустя 3 года после регистрации латанопроста в США в базе FDA была накоплена информация о 120 случаях макулярного отека на фоне применения латанопроста. Регулярные сообщения о случаях МО у больных глаукомой на фоне применения латанопроста с факторами риска (афакия, дефект задней капсулы, увеиты, сосудистая ретинальная патология) были отмечены в 1997, 1998, 1999 и 2002 гг. Так, E. Warwar в 1998 году отметил, что, несмотря на то что латанопрост зарекомендовал себя в качестве эффективного гипотензивного препарата, на фоне его применения авторами отмечено развитие макулярного отека и рецидив переднего увеита, преимущественно у пациентов с переднекамерной интраокулярной линзой, интраоперационным повреждением задней капсулы и увеитом в анамнезе. В 2000 году C. Lima фиксировал развитие макулярного отека на фоне терапии латанопростом при артифакии и афакии. К 2002 году был накоплен достаточный опыт по развитию макулярного отека на фоне применения других аналогов PGF2a. В настоящее время число публикаций по данной тематике составляет 124 работы согласно базе PubMed (рис. 2).
Таким образом, по данным многочисленных клинических исследований на фоне применения аналогов PGF2a возможно развитие макулярного отека у пациентов из соответствующей группы риска, что заставляет специалистов с настороженностью относиться к применению местных гипотензивных средств данной группы в определенных клинических ситуациях.
Страницы: 1 2