Гибель и утрата ГКС происходят задолго до первых проявлений глаукомных изменений в виде соответствующих дефектов полей зрения (ПЗ). Первые клинически выявляемые изменения ПЗ у больных глаукомой появляются только при потере приблизительно 40% зрительных волокон. По данным L. Kerrigan-Baumrind и H. Quigley (2000), это может отодвинуть выявление глаукомы на 10 лет от момента начала заболевания. Известно, что в норме за год от апоптоза гибнут 0,4% ГКС, в то время как при глаукоме частота апоптоза возрастает в 10 раз. Уже при начальной стадии глаукомы апоптозом охвачены до 14% ГКС.
В 2004 г. F. Cordeiro с соавторами разработали метод прижизненной оценки апоптоза ГКС, получивший название DARC (detection of apoptosing retinal cells). Этот метод предполагает использование специального красителя аннексина Y с флуоресцирующими частицами, который соединяясь с ГКС, вызывает их свечение при условии, что клетка находится в состоянии апоптоза. Для диагностики необходимы конфокальный сканирующий офтальмоскоп и специальный фотодетектор. В настоящий момент метод апробирован на лабораторных животных (рис. 2). Уже проводится первая стадия клинических испытаний технологии DARC при глаукоме. Перспективы данного метода очевидны. Это — ранняя диагностика глаукомы, определение скорости ее прогрессирования, возможности исследования патогенеза заболевания и новых нейропротекторов.
Особое внимание в докладе Ф. Кордейро было уделено планированию дизайна мультицентровых исследований потенциальных нейропротекторов. В 2012 г. H. Quigley опубликовал статью, в которой автор призывает продолжать эти исследования, несмотря на неудовлетворительный опыт изучения мемантина. В результате анализа большого количества исследований в области нейропротекторного лечения и динамического наблюдения за больными он предложил ограничить наблюдение минимальным сроком, который может составлять всего 3 года. Если уже на ранних этапах лечения замечено, что препарат не улучшает прогноз, то рекомендуется не продолжать его исследование. Вопрос о дозах также очень важен. Целесообразно изучать препарат сразу в нескольких вариантах дозирования, формируя заведомо несколько групп больных. По мнению автора, нейропротекторным действием обладает тот препарат, который позволяет снизить скорость прогрессирования на 30-40% от исходной скорости, которую необходимо установить в каждом индивидуальном случае до начала проведения исследования. Более того, согласно расчетам, проведенным H. Quigley, для получения доказательств того, что исследуемый препарат способен замедлить прогрессирование ГОН, достаточно обследовать 50 больных.
— Наталия Ивановна! Вы регулярно посещаете мировые конгрессы по глаукоме. Как Вы думаете, насколько эффективны поиски новых подходов к лечению глаукомы?
— Я думаю, что с появлением упомянутых мною выше новых технологий оценки апоптоза ГКС и новых методов планирования клинических исследований этот поиск может оказаться вполне эффективным, тем более что на сегодня известно большое количество субстанций, которые уже хорошо зарекомендовали себя в лабораторных исследованиях.
— Могли бы Вы выделить основные тренды в современной терапии глаукомы в Европе?
— Если говорить о местном медикаментозном лечении, то это, безусловно, применение препаратов без консервантов или, по крайней мере, без бензалкония хлорида (BAC-free). Это может существенно повысить комплаентность больных и их приверженность лечению. В лазерном лечении сохраняет свои позиции селективная лазерная трабекулопластика, с которой многие авторы рекомендуют начинать лечение глаукомы. Что касается хирургического лечения, то этот вопрос наиболее сложен, и неудовлетворенность офтальмологов результатами антиглаукомных операций сохраняется. Новые технологии микроинвазивной хирургии глаукомы, снижающие риск избыточного рубцевания путей оттока, безусловно, — наиболее перспективный путь.
— Как Вы думаете, сколько времени пройдет до появления эффективного препарата, который бы обладал прямым нейропротекторным действием на клеточном уровне?
— Боюсь, что этот путь не быстрый. Как уже подчеркивалось, наиболее сложный этап — клинические исследования, которые должны быть обязательно рандо- мизированными и плацебо-контролируемыми. Подобные исследования уже планируются в США и в Европе. Пока мы не знаем, какой именно препарат будет исследоваться (точно, что не мемантин).
— В кулуарах конференции активно обсуждалось выступление академика РАН и РАМН, председателя Комитета по науке и наукоемким технологиям Государственной Думы РФ Валерия Александровича Черешнева. Какие иммунологические аспекты ГОН затронул в выступлении академик В.А. Черешнев?
— Я бы сказала, что лекция академика В.А. Черешнева была сенсационной для офтальмологов, поскольку заставила серьезно задуматься о совсем иных причинах глаукомного поражения.

Академик РАН и РАМН В.А.Черешнев (Москва)
Оказывается, глаукоматозный процесс ассоциируется с вялотекущим неспецифическим хроническим воспалением с наличием неярко выраженной иммунной реакции, характеризующейся развитием нейродегенеративных процессов в слое нервных волокон и ганглиозных клетках сетчатки. Все это объединяет глаукому с другими нейродегенеративными заболеваниями: болезнью Паркинсона, хореей Гентингтона, гиперпролактинемией, боковым амиотрофическим склерозом. Причина их до недавнего времени была неизвестна. В 1980 г. сотрудник Калифорнийского университета в Сан-Франциско Стенли Прузинер при изучении нейродегенеративных заболеваний у животных (овец, обезьян), в частности почесухи и других схожих вариантов губчатой энцефалопатии, когда мозг становится похожим на швейцарский сыр, установил возбудителей этих заболеваний. Ими оказались не вирусы, не бактерии, не грибы, а... белки. В сложнейших изящных экспериментах он доказал, что возбудитель этих заболеваний содержит только неправильно свернутый вариант безвредного белка PrP. Для обозначения этой белковой инфекционной частицы Прузинер ввел термин «прион».
Сегодня значение термина «прион» расширилось и включает в себя белки, навязывающие свою форму другим, таким же белкам, но не обязательно вызывающим инфекционные болезни. Идеи Прузинера о том, что такие белки могут служить и переносчиками заболеваний, встретили активное противодействие. Но в 1997 г. его усилия были вознаграждены, и Стенли Прузинер получил Нобелевскую премию. Тщательное исследование болезни Альцгеймера и других нейродегенеративных состояний показало, что, не будучи заразными, они могут возникать и распространяться по мозгу аналогичным образом, за счет процесса, который запускается патогенными белками, то есть возникают те же прионоподобные механизмы. Примечательно, что неправильно скрученные белки вызывают эффект «домино», приводя к такому же неправильному скручиванию соседних молекул, после чего они слипаются друг с другом. Позже белки могут отрываться и вызывать аналогичный процесс уже совсем в другом месте. Небольшие скопления амилоида β (Аβ) застревают в синапсах (местах соединения нейронов) и могут замедлять химическую передачу сигнала между ними. Сенильные бляшки из Аβ, окружающие нервные клетки — типичный признак болезни Альцгеймера. Рост скоплений из Аβ неуклонно продолжается, поражая кору головного мозга и распространяясь в глубокие структуры — ствол и мозжечок. Накопление агрегатов из ненормально свернутых белков (protein misfolding), в частности Аβ, — это характерная черта и других нейродегенеративных заболеваний.
Это сходство означает, что прионная теория в скором времени расширит наши представления о том, как возникают и развиваются различные заболевания.
— Какое это может иметь отношение к глаукоме?
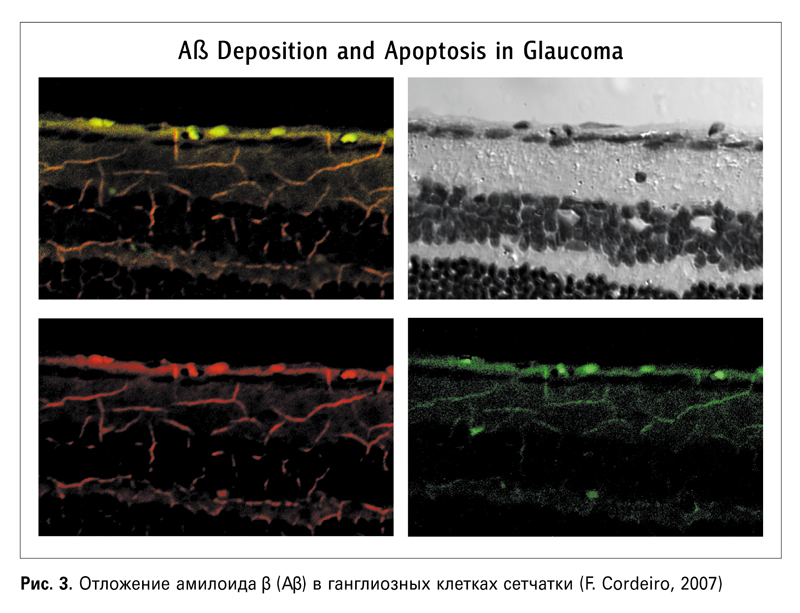
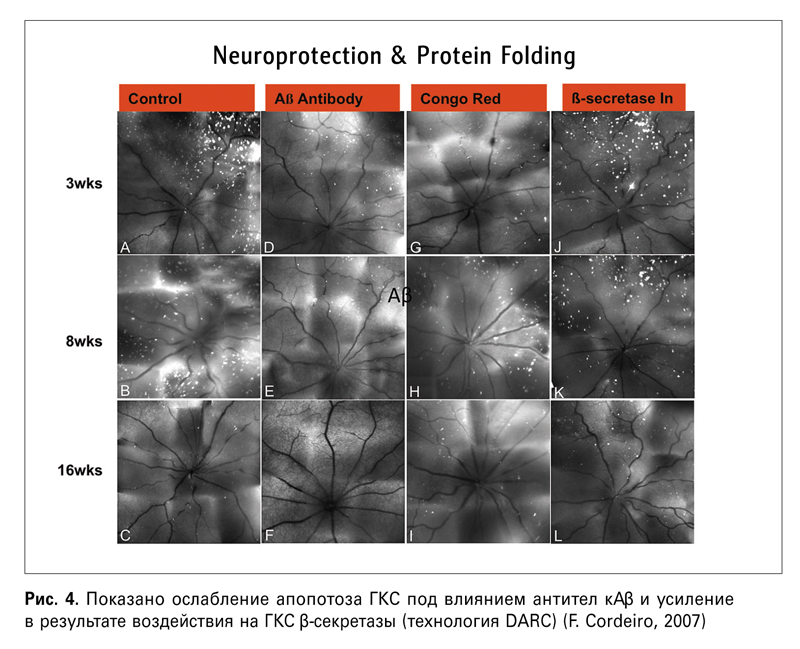
— Недавно было установлено, что амилоид β играет роль в патогенезе глаукомы (Goldblum D., 2007) и ВМД (Shimazawa M., 2008). В своей лекции профессор Кордейро, кстати, говорила о том же. Так, в 2007 г. с помощью упомянутой выше технологии DARC было обнаружено отложение Аβ в сетчатке лабораторных животных с глаукомой (рис. 3), а применение антител к амилоиду повышало выживаемость ГКС (рис. 4).
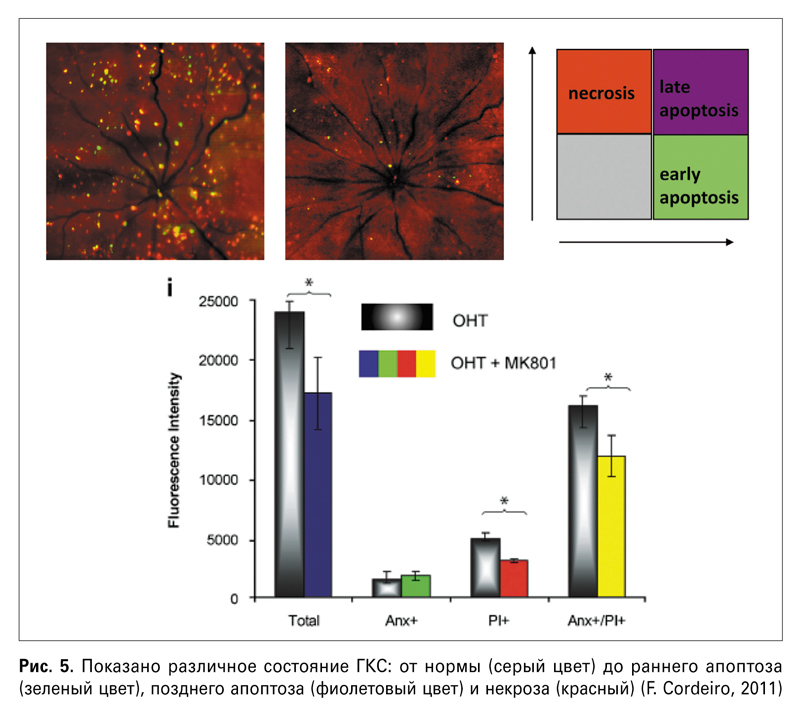
Проблемой болезни Альцгеймера, как это не покажется странным, сейчас очень интересуются именно офтальмологи. В ходе многочисленных исследований было замечено, что при болезни Альцгеймера имеется увеличение ЭДЗН, потеря ганглиозного слоя сетчатки, истончение неврального ободка и слоя нервных волокон по сравнению со здоровыми людьми. При болезни Альцгеймера снижен ретинальный кровоток, а в ГКС отмечено отложение амилоида β. Кстати, применение технологии DARC может оказаться актуальным и для ранней диагностики болезни Альцгеймера. Такие исследования уже проводятся группой профессора Кордейро. Интересно, что этой исследовательской группе удалось идентифицировать стадии апоптоза. Таким образом, уже сегодня можно наблюдать ГКС в состоянии раннего апоптоза, который, по мнению авторов, носит обратимый характер (рис. 5).
Интересно, что спустя неделю после нашей конференции разработчик теории приона и прионоподобных заболеваний нобелевский лауреат Стенли Прузинер прилетал в Санкт-Петербург на международный конгресс иммунологов. Академик В.А. Черешнев общался с ним, и они обсуждали глаукому как нейродегенеративное заболевание. Сейчас уже подошли очень близко к лечению прионоподобных заболеваний, эти исследования проводятся в лабораториях. Не исключено, что это будет означать новый виток в нейропротекции, в том числе и при глаукоме.